Видео:Вопросы врачу. Двустворчатый аортальный клапанСкачать

Пороки аортального клапана у взрослых: современная патология и показания к операции
Докт. мед. наук, профессор, кардиохирург, отдел сердечно-сосудистой хирургии РКНПК
В развитых странах кальцинированный аортальный порок является третьей по частоте встречаемости нозологической формой после артериальной гипертонии и ишемической болезни сердца [1].
Знание этиологии процесса, приведшего к аортальному пороку, может в значительной степени влиять как на хирургическую тактику, так и на протокол послеоперационного лечения пациентов и, в итоге, на прогноз отдаленного периода. Поэтому на всех этапах лечения следует стремиться ответить на вопрос об этиологии первичного процесса, вызвавшего дисфункцию клапана. Иногда этот ответ может дать только хирург, визуально оценивающий характер поражения клапана уже во время операции. В любом случае выяснение этиологии, даже с предположительным заключением, чрезвычайно важно.
Оценивая собственный опыт и опубликованные данные коллег из других российских клиник, нужно подчеркнуть, что и сегодня в кардиохи-рургических стационарах доминируют аортальные пороки ревматической этиологии, хотя и не так отчетливо, как в статистике полувековой давности. Эта цифра не превышает 30-40%. Однако если принять во внимание, что только за период с 1993 по 1998 г. в России частота кардиальной формы ревматизма возросла в 7 раз [2], то в будущем следует вновь ожидать увеличения числа пациентов с ревматическими клапанными пороками.
Рост хирургических вмешательств на аортальном клапане в группе пациентов старше 60 лет значительно увеличил число атеросклеротических «дегенеративных» (возрастных) пороков аортального клапана. Если аортальный порок умеренно выражен и сочетается с распространенным атеросклерозом коронарных артерий, аорты и ее ветвей в сочетании с отчетливыми специфическими нарушениями в показателях липидного обмена (общий холестерин, липопротеиды низкой плотности, триглицериды), то атеросклеротическое происхождение процесса на клапане сомнений не вызывает. Это особая и прогностически наиболее тяжелая группа больных. Именно на эту категорию пациентов распространяется точка зрения некоторых авторов, что аортальный стеноз — это особая форма проявления атеросклероза с идентичными для данного системного заболевания факторами риска.
В реальной же клинической ситуации не более 50% пожилых пациентов с признаками аортального стеноза имеют изменения коронарных сосудов 4. У таких пациентов имеется другой дистрофический процесс в клапане со сниженным в силу возрастных изменений уровнем метаболических реакций: атеросклероз как таковой может лишь играть роль ускоряющего фактора, особенно если сопровождается специфическими для многих атером воспалительными изменениями створок аортального клапана за счет инвазии Chlamydia pneumoniae [6, 7]. Возрастная инволюционная кальциевая дегенерация — это, на наш взгляд, наиболее подходящее определение для такой патологии аортального клапана. Как особая форма она часто встречается у пожилых пациентов и, как правило, при анализе попадает в группу атеросклеротических пороков. Диагностическая грань между этими двумя группами пациентов (атеросклероз и возрастная дистрофия) очень тонкая, но провести ее при известном опыте вполне реально. Практическое значение такой диагностики может выразиться не только в различном прогнозе, но и в объеме медикаментозной терапии после операции(применение антиагрегантов, гиполипидемических средств).
К этому же типу «дегенеративных» пороков с выраженной кальцификацией примыкает группа пациентов с врожденной двухстворчатой конфигурацией аортального клапана. Для нас это оказалось неожиданным, но число таких пациентов возрастает по мере увеличения числа оперированных пожилых больных.
Собственно, уже отмеченные нами три основные причины аортальных пороков сердца вкупе составляют не менее 90% причин стеноза аортального клапана [5, 8-13]. Все эти причины приводят к различным патоморфологическим, но однотипным функциональным изменениям створок аортального клапана, ограничивая их подвижность. Этот процесс (фиброз, утолщение, образование спаек в области комиссур, кальцификация) всегда протекает длительно — годы, а то и десятилетия. Среди других, более редких причин аортального стеноза следует отметить перенесенный и активный инфекционный эндокардит, системную красную волчанку (бородавчатый асептический эндокардит Либмана-Сакса), такие наследственные нарушения метаболизма, как гомозиготная гиперлипопротеинемия II типа и алкаптонурия (ochronosis), метастатическая кальцификация аортального клапана у пациентов с хронической почечной недостаточностью 15.
Чистая или доминирующая аортальная недостаточность встречается значительно реже, чем стеноз. При комбинированном поражении наиболее частой причиной является ревматический вальвулит, приводящий к сморщиванию и укорочению створок аортального клапана. Значительную роль играет инфекционный эндокардит, формирующий аортальную недостаточность либо на нативном клапане, либо изменяя естественное течение таких аномалий, как двухстворчатый или пролабирующий аортальный клапан. И все-таки, несмотря на то, что ревматизм является наиболее частой причиной аортальной недостаточности и при данной нозологии не является абсолютно доминирующим процессом, другие причины аортальной недостаточности в совокупности значительно более разнообразны, чем при аортальном стенозе. Все это многообразие может быть разделено на три патоморфологичес-кие группы:
• аортальная недостаточность с изменением только полулунных створок (ревматизм, инфекционный эндокардит, двухстворчатый клапан, пролапс створок);
• аортальная недостаточность в результате патологии восходящей аорты при анатомически неизмененных створках (синдром Марфа-на, синдром Элерса-Данлоса, сифилитический аортит, анкилозирую-щий спондиллит, расслаивающая аневризма восходящей аорты);
• аортальная недостаточность при анатомически сохраненных аорте и аортальных створках (вторичный пролапс при дефекте межжелудочковой перегородки, гипертоническая болезнь).
Симптомокомплексы, характерные для того или иного клапанного порока, определяют современную лечебную тактику в значительно большей степени, чем собственно характер поражения аортальных створок. Поэтому любая попытка обозначить диагноз состояния, обосновать показания к хирургическому вмешательству и хирургическую тактику только на данных топической диагностики (диаметр отверстия, величина пролабиро-вания створок, величина перепада давления на клапане, наличие или отсутствие признаков кальциноза и т.п.) не свидетельствует в пользу всесторонне проведенного клинического анализа состояния конкретного пациента.
Кардиологи сегодня надежно диагностируют эту патологию и своевременно отправляют таких пациентов к кардиохирургам. И все-таки при решении вопроса об операции у пациентов старше 70 лет мы иногда встречаем определенное сопротивление наших коллег-кардиологов. В основе их сомнений лежат как объективный фактор — более высокий риск операции, так и субъективный — неизвестность индивидуально «запрограммированной» продолжительности жизни таких пожилых пациентов.
Поэтому в настоящей публикации мы специально приводим данные O’Keefe et al., [17], которым удалось проследить группу из 50 пациентов, ожидающих операцию баллонной дилатации стенозированного аортального клапана. Средний возраст пациентов превышал 70 лет, выживаемость без операции к 3-му году наблюдения составила лишь 25%. В то же время в рандомизированной группе больных без аортальной патологии показатель выживаемости составил 77%. Если учесть, что сегодня летальность при аортальном протезировании минимальна, то эти данные должны убедительно доказывать кардиологам необходимость оперативного пути лечения таких пациентов.
В классических ситуациях вопрос «когда оперировать?» не представляет затруднений: цифровая рентгенография с экрана электронно-оптического преобразователя, ЭКГ, ЭхоКГ, МРТ с контрастированием — достаточные методики для постановки топического диагноза и оценки состояния левого желудочка сердца. Выполнение зондирования полостей сердца у пациентов с аортальными пороками с целью определения перепада давления, объема регургитации, конечно-диастоли-ческого давления в левом желудочке или давления заклинивания легочных капилляров сегодня уже можно расценивать как диагностический анахронизм.
В своей практике мы, естественно, особенно настороженно относимся к выбору решения у пациентов с «малыми» симптомами и, тем более, у пациентов с бессимптомным течением. Известно, что клинические проявления и жалобы могут отсутствовать даже при выраженном тяжелом аортальном стенозе с площадью отверстия менее 0,8 см3 и со снижением фракции изгнания до 25-30% [18].
Увеличение левого желудочка сердца до 6 см и более (у пациентов с аортальной недостаточностью), равно как и гипертрофия с перегрузкой левого желудочка (у пациентов с аортальным стенозом), — достаточные инструментальные критерии необходимости операции при наличии топического диагноза.
Допплеровская ЭхоКГ позволяет практически с такой же точностью, как зондирование левого желудочка, установить величину перепада давления. Понимая условность и многофакторную зависимость этого показателя, мы считаем его величину в 40-50 мм рт. ст. достаточным основанием для более детального обследования пациента и поиска аргументов в пользу операции.
Расчет величины эффективного отверстия менее зависим от особенностей тока крови через участок «левый желудочек-аортальный клапан-восходящая аорта», но и этот показатель является достаточно условным и «полуколичественным». И все же указания специалистов по УЗ-диагностике на ограничение раскрытия створок клапана менее 1,5 см мы обязательно учитываем, а при размере отверстия менее 1 см показания к операции почти абсолютны. Еще более точным выражением степени стеноза является отношение размера стеноза к общей площади поверхности тела — величина менее 0,6 см/м2 является критической [19]. Если при этом есть информация о кальцинозе клапана, то откладывать с операцией не стоит, так как прогрес-сирование процесса неизбежно.
Если аргументы в пользу операции не абсолютны, то при аортальном стенозе делаем расчеты потери давления на клапане (мм рт. ст./мл ударного объема) — величина 1 мм рт. ст./мл и более значима и весома. При необходимости повторяем эти расчеты при нагрузке. При аортальной недостаточности уменьшение фракции изгнания менее 55% и ее дальнейшее снижение (или неизменность) в условиях нагрузочного теста также свидетельствуют о пределе компенсаторных резервов миокарда левого желудочка и служат более чем убедительным критерием в пользу операции.
При наличии сопутствующей коронарной патологии, требующей хирургической коррекции, или сопутствующих пороков митрального клапана критерии для ревизии и вмешательства на аортальном клапане могут быть значительно более либеральными и часто определяются индивидуальным решением оперирующего хирурга.
Следует помнить, что аортальный стеноз прогрессирует вне зависимости от каких-либо закономерностей. Однако при дегенеративных пороках этот процесс идет быстрее, чем при ревматических или при наличии двухстворчатого клапана. При медленном прогрессировании отверстие аортального клапана суживается по 0,02 см2 в год, а при быстром — более 0,3 см2 в год. При достижении пиковой скорости кровотока через клапан около 4 м/с двухлетняя выживаемость без хирургии составляет лишь 21%. Таким образом, кальцификация, быстрота прогрессирования стеноза в течение года и положительные нагрузочные тесты (незначительный подъем или даже снижение артериального давления при нагрузке) — реальные факторы для решения вопроса об операции при асимптомном течении аортального стеноза.
При асимптомной аортальной недостаточности прогноз строится на оценке функции левого желудочка и степени дилатации восходящей аорты. Угрожающими признаками является увеличение конечно-диастолического давления левого желудочка более 70 мм, конечно-систолического давления более 50 мм (индекс более 25 мм/м2 поверхности тела пациента), снижение фракции изгнания до 50%. При расширении восходящей аорты более 55 мм операцию следует предлагать независимо от степени аортальной недостаточности и функции левого желудочка. У пациентов с двухстворчатым клапаном или при синдроме Марфана показания к операции еще более жесткие — пороговый для принятия решения диаметр восходящей аорты составляет 50 мм.
Постоянный плановый контроль состояния необходим всем пациентам с симптомами аортального порока и обязателен каждые 12 мес, чтобы не упустить время возможного выполнения хирургических вмешательств.
1. Jund B. et al. // Eur. Heart J. 2002. V. 23. P. 1253.
2. Болезни сердца и сосудов // Патологическая анатомия / Под ред. Пальце-ваМ.А., Аничкова Н.М. Т. 2.Ч. 1. Гл. 11. М., 2001. C. 8.
3. Lindroos M. et al. //J. Amer. Coll. Cardiol. 1993. V. 21. P. 1220.
4. Iivanainen A.M. et al. // Amer. J. Cardiol. 1996. V. 78. P. 97.
5. Stewart B.F. et al. //J. Amer. Coll. Cardiol. 1997. V. 29. P. 630.
6. Nystrom-Rosander С et al. // Scand. J. Infect. Dis. 1997. V. 29. P. 361.
Читайте также: Датчик температуры всасываемого воздуха ваз 2110 инжектор 8 клапанов
7. Juvonen J. et al. // J. Amer. Coll. Cardiol. 1997. V. 29. P. 1054.
8. Passik C.S. et al. // Mayo Clin. Proc. 1987. V. 62. P. 119.
9. Davies M.I. Butterworths. L., 1980.
10. Subramanian R. et al. // Mayo Clin. Proc. 1984. V. 59. P. 683.
11. Subramanian R. et al. // Mayo Clin. Proc. 1985. V. 60. P. 247.
12. Peterson M.D. et al. //Arch. Pathol. Lab. Med. 1985. V. 109. P. 829.
13. David T.E.//J. Heart Valve Dis. 1999. V. 8. P. 495.
14. Roberts W.C. et al. // Amer. J. Cardiol. 1973. V. 31. P. 557.
15. Roberts W.C. et al. // Circulation. 1967. V. 36. P. 449.
16. Pritzker M.R. et al. // Ann. Intern. Med. 1980. V. 93. P. 434.
17. O’Keefe J.H. et al. // Mayo Clin. Proc. 1987. V. 62. P. 986.
18. Corabello B. // J. Heart Valve Dis. 1995. V. 4. Suppl. 11. P. 132.
19. Rahimtoola S.H. //J. Amer. Coll. Cardiol. 1989. V. 14. P. 1.
Статья опубликована в журнале Атмосфера. Кардиология
Видео:Болезни аортального клапана: аортальный стеноз, недостаточность аортального клапана.Скачать

Аортальный клапан амплитуда раскрытия створок
1. Площадь отверстия аортального клапана. У здорового человека площадь отверстия аортального клапана (ПОАК) составляет 3-4 см 2 . Согласно рекомендациям Американской коллегии кардиологов и Американской ассоциации кардиологов (АСС/АНА), выделяют три степени стеноза аортального клапана, основываясь на площади отверстия клапана. По сравнению с ранее предложенными классификациями, граничные значения площади открытия «смещены» вверх, так что о тяжелом стенозе аортального клапана говорят лишь в том случае, если площадь его отверстия меньше 1,0 см 2 (высокая степень стеноза). Умеренный стеноз соответствует площади отверстия клапана 1,0-1,5 см 2 , а при легком стенозе площадь отверстия больше 1,5 см 2 .
2. Другие параметры. Наряду с эхокардиографическим определением площади отверстия аортального клапана для оценки степени стеноза предложено определять и целый ряд других эхокардиографических параметров. Приведенные в таблице ниже граничные значения для тяжелого стеноза (стеноза высокой степени) можно использовать лишь как ориентировочные и в комплексе с другими параметрами, которые мы обсудим в следующем разделе.
а) Сепарация створок аортального клапана. С помощью ЭхоКГ в М-режиме и двумерной ЭхоКГ можно выяснить, как происходит сепарация полулунных заслонок аортального клапана. Уже в самом начале внедрения этих методов их стали использовать для количественной оценки аортального стеноза. Если при открытии аортального клапана движение одной заслонки не ограничено, значительный аортальный стеноз можно исключить. Допуская, что конфигурация аортального клапана при открытии круглая, можно по сепарации заслонок рассчитать площадь отверстия аортального клапана:
— Сепарация 12 мм => ПОАК 1,13 см 2 ,
— Сепарация 11 мм => ПОАК 0,95 см 2 ,
— Сепарация 10 мм => ПОАК 0,8 см 2 ,
— Сепарация 9 мм => ПОАК 0,65 см 2 ,
— Сепарация 8 мм => ПОАК 0,5 см 2 .
Если конфигурация аортального клапана при открытии утрачивает круглую форму, то при определении площади отверстия аортального клапана она в зависимости от направления ультразвукового луча получается завышенной или заниженной. Наконец, при сильном обызвествлении клапана можно получить заниженные значения сепарации и тем самым завышенную степень стеноза. Тем не менее несмотря на го, что с помощью ЭхоКГ в М-режиме и двумерной ЭхоКГ можно достоверно определить сепарацию заслонок аортального клапана и на основании этого параметра исключить аортальный стеноз, основываться на одном лишь этом параметре при определении степени стеноза аортального клапана не следует.
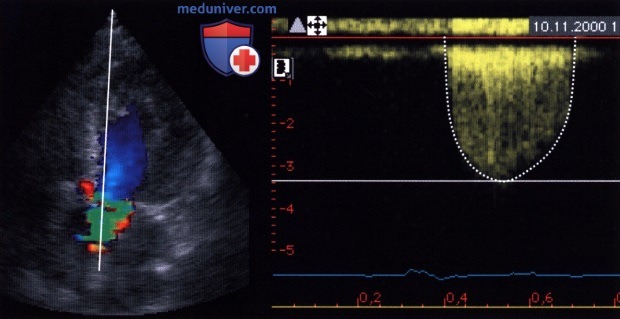
б) Максимальная скорость кровотока. При аортальном стенозе ток крови через стенозированный клапан ускоряется и струя сужается. Будучи вначале ламинарной, она на расстоянии нескольких миллиметров от стенозированного отверстия максимально сужается («сжатая вена»). Именно на этом уровне она достигает максимальной скорости, далее из-за появления нарастающей турбуленции струя постепенно расширяется.
Максимальная скорость струи является простым параметром для оценки степени аортального стеноза. В статье Otto и соавт. показано прогностическое значение данного параметра у больных с аортальным стенозом.
1. Расположение датчика. Для правильного определения максимальной скорости кровотока ультразвуковой луч следует направить коаксиально струе крови. Поскольку направление ультразвукового луча зависит от морфологических особенностей клапана и изменений в нем, а также положения плоскости аортального клапана, которое неодинаково у разных пациентов, при определении максимальной скорости кровотока следует подбирать оптимальную позицию ультразвукового датчика. Наиболее часто аортальный клапан лоцируют со стороны верхушки сердца, в других случаях прибегают к лоцированию из левой парастернальной, правой парастернальной, супрастернальной и, редко, субкостальной позиции датчика.
2. Настройка эхокардиографа. Поскольку при аортальном стенозе скорость стенотической струи крови высокая, необходимо допплеровское исследование в непрерывноволновом режиме. В некоторых случаях облегчить поиск аортальной струи крови можно с помощью цветового допплеровского картирования. Определенную роль играет пальпация грудной стенки, так как ощущение дрожания, характерного для аортального стеноза, помогает подобрать нужную позицию датчика, т.е. в том месте, где дрожание ощущается особенно отчетливо. В отдельных случаях имеет смысл применять допплеровские датчики с автономной системой («слепые», или карандашного типа), у которых по сравнению с датчиками для исследования в М- и В-режимах и обычными допплеровскими датчиками отношение сигнал/шум более высокое.
Современные ультразвуковые аппараты последнего поколения позволяют определить максимальную скорость кровотока примерно у 90% больных. Лишь при регистрации профиля скоростей с отчетливой огибающей можно достичь адекватной регистрации струи кровотока. Это является необходимым условием для определения скорости кровотока.
3. Эхоконтрастные растворы. Если качество сигнала плохое из-за его ослабления (например, у пациентов с ожирением или эмфиземой легких) или отклонения допплеровского курсора от центрального положения (например, при деформации грудной клетки), то можно усилить сигнал, вводя больному эхоконтрастный раствор, который проходит через легочное капиллярное русло. Введение эхоконтрастного раствора Левовист, Оптизон, Соновью или Альбунекс позволяет увеличить отношение сигнал/шум, сделать допплеровский профиль скоростей более отчетливым, не вызывая рассеяния сигнала, и, следовательно, избежать получения завышенного значения. В сравнительных исследованиях удалось показать, что точность измерения градиента давления при введении эхоконтрастного раствора повышается. Следует подчеркнуть, что введение контрастного вещества оправданно тогда, когда качество сигнала из-за плохих условий лоцирования, например у больных с эмфиземой легких или ожирением, недостаточно для отграничения максимальной скорости кровотока от артефактов. Компенсировать низкое качество акустического сигнала, связанное с неоптимальным углом между ультразвуковым лучом и направлением струи крови, путем введения эхоконтрастного вещества невозможно!
в) Максимальный и средний градиент давления. Зная скорость кровотока до стенозированного аортального клапана (V1) и максимальную скорость стенотической струи крови (V2), можно по уравнению Бернулли определить градиент давления на аортальном клапане:
Если скорость кровотока до места стеноза низкая (V1 2 2 ), уравнение Бернулли можно в упрощенном виде записать так:
По максимальному значению скорости кровотока, которое достигается во время систолы, рассчитывают максимальное мгновенное значение градиента давления на клапане.
Среднее значение градиента давления (ΔP m ) определяют по соответствующему градиенту давления для каждого значения скорости в каждый момент систолы на основании приведенной выше формулы:
При ручном или автоматическом контурировании спектральной кривой скорости кровотока указанные расчеты в имеющихся на сегодняшний день аппаратах осуществляются автоматически.
Определение максимального и среднего градиента давления по упрощенному уравнению Бернулли в настоящее время является общепризнанным методом. В ряде сравнительных исследований (как клинических, так и экспериментальных) выявлена корреляция между значениями градиента давления, рассчитанного по уравнению Бернулли на основании результатов допплеровской оценки скорости кровотока, и значениями, полученными при измерении датчиками давления, вводимыми при зондировании полостей сердца.
Градиент давления, рассчитанный по значениям допплеровской скорости кровотока, не несет существенной дополнительной информации по сравнению со значениями самой скорости кровотока (исключение составляют случаи, при которых престенотическая скорость V1 высокая и должна учитываться в уравнении Бернулли). Тем не менее этот градиент сравним с градиентом, измеренным инвазивно при катетеризации полостей сердца, что облегчает врачу интерпретацию полученных при измерениях значений.
г) Причины расхождения «допплеровских» градиентов давления и градиентов давления, измеренных при зондировании сердца. В отдельных случаях значения градиентов давления на аортальном клапане, определенных с помощью допплеровского исследования и при катетеризации полостей сердца, все же существенно расходятся. Высказано несколько точек зрения на несоответствие этих результатов. Регистрация не всего профиля спектральной кривой скоростей и неоптимальный угол между ультразвуковым лучом и направлением стенотической струи крови — причины получения заниженного значения градиента давления. Ошибочное лоцирование струи митральной регургитации вместо стенотической струи через аортальный клапан дает завышенные значения допплеровского градиента давления. Методические различия в измерении межпикового градиента и мгновенного пикового градиента могут быть причиной получения завышенных значений градиента давления. При выборе нерепрезентативного сердечного сокращения значение градиента давления при допплеровском его определении может оказаться как завышенным, так и заниженным. Наконец, объяснить завышенные значения «допплеровского» градиента можно феноменом восстановления давления.
1. Нерегистрируемая максимальная скорость струи. Иногда при регистрации потока крови через стенозированный аортальный клапан исследователь не учитывает скорость узкой высокочастотной струи кровотока, что, как правило, является следствием неоптимальных условий регистрации ЭхоКГ или недостаточного опыта врача-сонолога. Так, престенотическую скорость струи крови можно ошибочно принять за постстенотическую, в результате расчетный градиент давления оказывается значительно заниженным. Ошибку можно исключить тогда, когда в «профиле струи» содержится еще второй низкочастотный профиль, который соответствует престенотической скорости V1.
2. Угловая погрешность. Позиция допплеровского датчика, обусловливающая неортогональное направление ультразвукового луча относительно направления струи, вызывает заниженные значения скорости кровотока и тем самым градиента давления. Погрешность, обусловленная углом а, сохраняется и в том случае, когда в расчетах используется косинус этого угла. Значение скорости при угле а 20° оказывается заниженным на 6%, при угле α 40° — на 24%, а при угле а 60° — на 50%. Хотя угол между ультразвуковым лучом и направлением струи учитывается во всех современных ультразвуковых аппаратах и вносится необходимая поправка, тем не менее ошибка возможна и при поправке на этот угол, и значения скорости могут оказаться как заниженными, так и завышенными. Поэтому рекомендуется полностью отказаться от поправки на угол и стараться позиционировать датчик таким образом, чтобы направление ультразвукового луча совпадало с направлением струи крови, т.е. чтобы значение скорости было максимальным и аудиосигнал регистрировался по возможности без отклонения от направления струи.
3. Пренебрежение подклапанной скоростью кровотока. Как было сказано ранее, при расчете градиента давления по упрощенному уравнению Бернулли (ΔP = 4V2 2 ) престенотической скоростью кровотока V1 пренебрегают. При высоких скоростях кровотока в выносящем тракте левого желудочка, например при наличии гемодинамически значимой аортальной недостаточности или ускорении потока вследствие подклапанной мембраны или при гипертрофической обструктивной кардиомиопатии, значение градиента на аортальном клапане получается завышенным. В этих случаях необходимо учитывать значение престенотической скорости V1, а градиент на стенозированном клапане определять по формуле ΔP = 4(V2 2 -V1 2 ).
4. Допплеровское определение «ложной» струи. Если у больного имеется эксцентрическая струя митральной недостаточности, то при допплеровском исследовании можно ошибочно принять эту струю за струю, проходящую через стенозированный аортальный клапан. Значения скорости потока крови при этом, как правило, оказываются существенно завышенными. Об этом следует помнить, если при регистрации кровотока через аортальный клапан скорость кровотока оказывается неожиданно высокой. Ошибку можно выявить, переключив режим работы ультразвукового сканера, в частности выполняя двумерную ЭхоКГ или цветовое допплеровское картирование. Дифференциальная диагностика возможна и по динамике профиля струи, характерной для аортального стеноза и митральной недостаточности: струя митральной регургитации возникает раньше и длится дольше, чем стенотический поток крови при аортальном стенозе.
Читайте также: Регулирующий клапан с пневматическим приводом
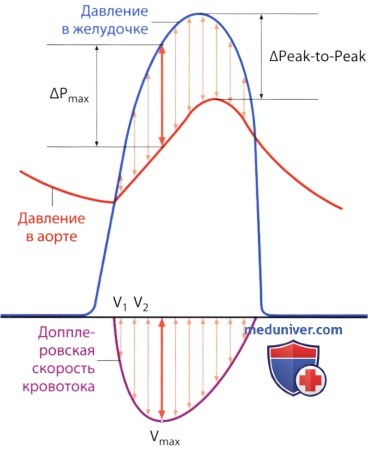
5. Различия между межпиковым (Peak-to-Peak) и мгновенным пиковым градиентом давления. Методологические различия между определением межпикового и максимального мгновенного пикового градиента давления могут стать причиной завышенных значений градиента. Следует учесть, что максимальное значение допплеровской кривой, так называемый максимальный допплеровский градиент давления, вполне соответствует мгновенному максимальному градиенту, определенному при катетеризации полостей сердца и аорты. Тем не менее при катетеризации обычно измеряют разницу между пиками кривой давления в аорте и в левом желудочке, т.е. так называемый «межпиковый градиент давления» (Peak-to-Peak) с помощью имеющихся на зонде датчиков давления.
Поскольку максимальные (пиковые) значения давления в левом желудочке и в аорте достигаются не одновременно, то о межпиковом градиенте давления говорят лишь условно; определить его с помощью допплерографии невозможно. Мгновенный пиковый градиент давления, как правило, больше межпикового. Поданным одного исследования, он превышал межпиковый градиент в среднем на 20 мм рт.ст.
6. Выбор нерепрезентативного сердечного сокращения. При выраженной вариабельности интервала R—R, например при фибрилляции предсердий или при экстрасистолии, максимальное значение скорости кровотока при различных сердечных циклах может существенно различаться. Если для определения градиента давления выбрать постэкстрасистолическое сердечное сокращение или сокращение, которое происходит после длительного R-R интервала (при мерцательной аритмии), то значение градиента давления может оказаться завышенным.
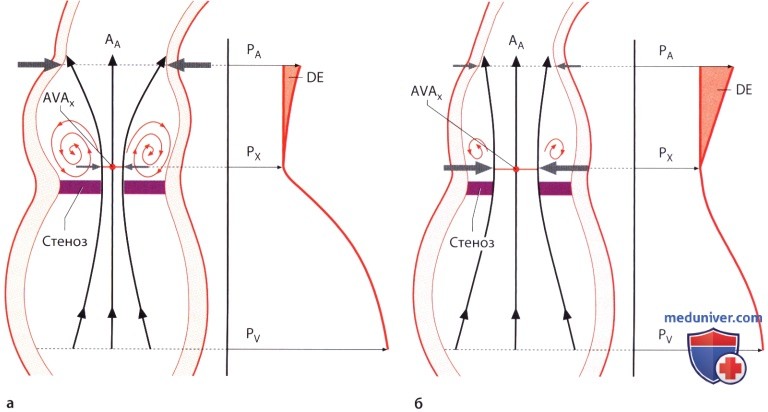
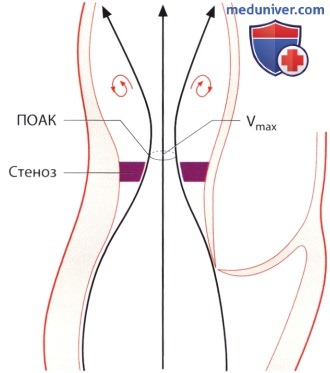
а — При выраженном стенозе (AVAX) и одновременном расширении аорты (AA) возникает значительная турбулентность и поэтому восстановление давления (DE) оказывается небольшим.
б — При небольшом стенозе (AVAX) и одновременно неширокой аорте (AA) турбулентность потока крови не столь выражена, поэтому происходит значительное восстановление давления (DE). 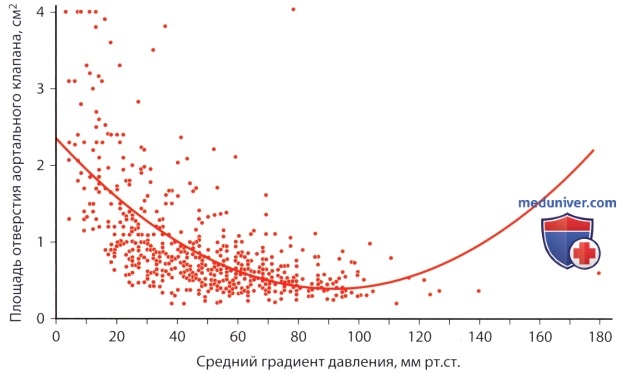
7. Феномен восстановления давления. Феномен восстановления давления (в англоязычной литературе «pressure-recovery» phenomenon) — еще одна возможная причина расхождения между значениями градиента давления, рассчитанного по результатам допплерографии и определенного при катетеризации полостей сердца. Под этим феноменом понимают повторное повышение давления за стенозированным участком. Это известный феномен в гидродинамике. При аортальном стенозе наиболее низкое давление регистрируется на уровне, соответствующем наибольшей скорости потока (т.е. на уровне «vena contracta»). Дистальнее давление частично повышается до значения, соответствующего стенозу. Иными словами, скорость потока вновь преобразуется в давление. Повторное повышение давления бывает выражено тем больше, чем меньше турбулентность потока и тем самым потери энергии дистальнее стеноза. Если аорта узкая и стеноз незначительный, турбулентность потока крови и связанные с этим потери в виде кинетической энергии незначительны. Значительная часть кинетической энергии может вновь превратиться в потенциальную энергию и тем самым трансформироваться в давление. При широкой аорте и выраженном стенозе аортального клапана турбулентность потока достигает такой степени, что восстановление давления оказывается незначительным.
8. Клиническое значение феномена восстановления давления. Клиническое значение феномена восстановления давления как причины несоответствия градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, состоит в том, что в первом случае максимальную скорость потока определяют сразу дистальнее клапана на уровне «vena contracta», где давление достигает минимума, а во втором случае, т.е. при зондировании сердца, давление измеряют дистальнее уровня его восстановления, т.е. существенно дистальнее стенозированного клапана вне стенотической струи. Таким образом, в отличие от допплерографии, при зондировании полостей сердца указывается градиент давления между желудочком и аортой, в котором уже учтено повторное повышение давления (т.е. феномен восстановления давления).
Клиническое значение феномена восстановления давления и необходимость учитывать его в отдельных случаях при сравнении значений градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, показаны в ряде исследований. Кроме того, оказалось, что степень восстановления давления зависит от степени аортального стеноза и диаметра аорты. В исследовании Baumgartner и соавт. у 7 из 23 больных с аортальным стенозом восстановление давления составило более чем 20 мм рт.ст. По данным этих авторов, расхождение в значении градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, превышало более 20 мм рт.ст. лишь у больных, у которых диаметр аорты был менее 3 см. У одного больного с гипоплазией аорты (диаметр аорты 1,7 см) восстановление давления достигало 75 мм рт.ст.
Восстановление давления в аорте в процентном отношении можно рассчитать по эффективной площади отверстия аортального клапана (AVAX) и площади поперечного сечения восходящей аорты АA. Согласно формуле, выведенной из законов сохранения массы и импульса, отношение восстановления давления к максимальному градиенту давления на клапане пропорционально площади стенозированного клапана AVAX и обратно пропорционально площади поперечного сечения аорты АA:
Восстановление давления / Максимальный градиент = 2 (AVAX/AA — AVAX 2 /AA 2 .
Ниже приводим два примера, поясняющих значение данного феномена:
— У больного с гемодинамически значимым аортальным стенозом (AVAX 0,5 см 2 ) и диаметром аорты 4 см (площадь поперечного сечения аорты 12,6 см 2 ) восстановление давления составляет 8%.
— При умеренном аортальном стенозе (AVAX 1,2 см 2 ) и узкой аорте (диаметр 2,5 см, площадь поперечного сечения аорты 4,9 см 2 ) восстановление давления составляет 37%.
Таким образом, феномен восстановления давления у больных с высокой степенью аортального стеноза не влияет на принятие тактических решений. Однако он может быть причиной расхождения между значениями градиента давления, рассчитанного по данным допплерографии и измеренного при катетеризации полостей сердца и аорты, что следует учитывать у больных с легким и умеренным аортальным стенозом в сочетании с узкой аортой.
д) Площадь отверстия аортального клапана. Как известно, градиент давления на стенозированном клапане зависит от потока крови через него, поэтому для определения степени стеноза клапана градиент давления подходит лишь условно. На рисунке ниже показано ограниченное значение градиента давления на клапане при определении степени стеноза клапана: у больных с аортальным стенозом зависимость между градиентом давления и площадью отверстия аортального клапана более слабая. Поэтому диагностическая ценность одного лишь определения градиента давления для распознавания гемодинамически значимого аортального стеноза ограничена. Умеренный градиент, превышающий 50 мм рт.ст., хотя и более специфичный признак (84%), но менее чувствителен (66%) в диагностике гемодинамически значимого аортального стеноза (AVAX 2 ).
Существует два различных способа эхокардиографического определения площади отверстия аортального клапана. По одному из них площадь отверстия аортального клапана рассчитывают из уравнения непрерывности потока. По второму ее определяют планиметрически на основании изображения аортального клапана, полученного с помощью трансторакальной или чреспищеводной ЭхоКГ. Расчет площади отверстия аортального клапана по формуле Горлина на основании данных допплеровского исследования нецелесообразен, так как формула Горлина получена из уравнения непрерывности потока. Это было бы неоправданным увеличением вычислений, так как полученные с помощью ЭхоКГ значения скорости надо будет сначала преобразовать в градиент давления, а затем значение градиента давления вставить в формулу Горлина.
1. Планиметрия. При ЧПЭ плоскость аортального клапана можно лоцировать вертикально вдоль короткой оси на уровне середины пищевода (при угле поворота датчика от 30 до 70°). Планиметрическое определение площади отверстия клапана осуществляют не менее трех раз, беря за основу отверстие вдоль внутреннего края клапана при максимальном его открытии. По данным некоторых авторов, между значениями площади отверстия аортального клапана, измеренной при ЭхоКГ и при зондировании сердца по формуле Горлина, имеется тесная корреляция. Определять площадь отверстия аортального клапана планиметрическим методом в настоящее время можно и при трансторакальной ЭхоКГ. Однако даже при удовлетворительных условиях выполнения этого исследования все же возможна значительная погрешность результатов. Часто не удается четко различить края отверстия аортального клапана и, следовательно, достоверно определить степень стеноза, особенно если имеются значительные морфологические изменения в клапане и выраженный его кальциноз. Завышенные значения площади отверстия аортального клапана при планиметрии можно получить в том случае, если рассматривать аортальный клапан в плоскости, соответствующей уровню не заслонок, а основания.
Чреспищеводная ЭхоКГ при планиметрическом определении площади отверстия аортального клапана, несомненно, более предпочтительна по сравнению с трансторакальной. При умеренном стенозе аортального клапана и отсутствии его кальциноза измерение площади его отверстия обычно не представляет трудностей. При кальцинозе клапана и сложном изменении его геометрии возможности ЧПЭ столь же ограничены, как и трансторакальной. Иногда отверстие открытого аортального клапана из-за артефактов «повторного эха» и очагов обызвествления видно нечетко. Кроме того, следует отметить, что обызвествленный и фиброзно-измененный стенозированный аортальный клапан бывает настолько деформирован, что применение лишь одного метода визуализации для измерений оказывается недостаточным. Какое место может занять трехмерная ЭхоКГ с ее более сильным пространственным разрешением в исследовании сложной геометрии стеноза аортального клапана, предстоит еще выяснить.
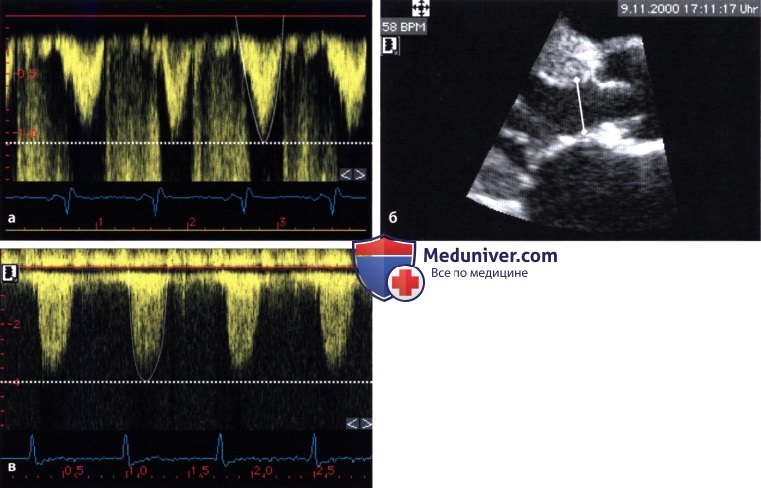
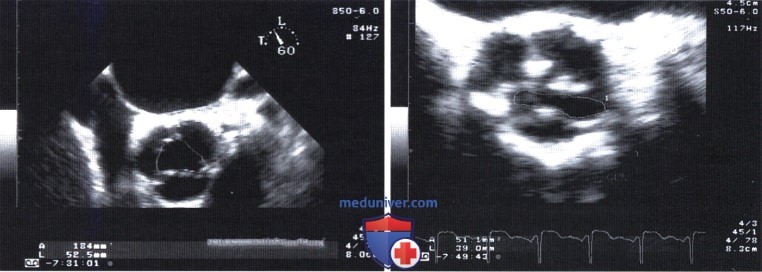
а — Допплерография в импульсном режиме: кровоток в выносящем тракте левого желудочка: V1 =110 см/с.
б — Двумерная ЭхоКГ: диаметр выносящего тракта левого желудочка: D = 2,4 см. в — Непрерывноволновая допплерография стенотической струи: скорость V2 = 400 см/с. 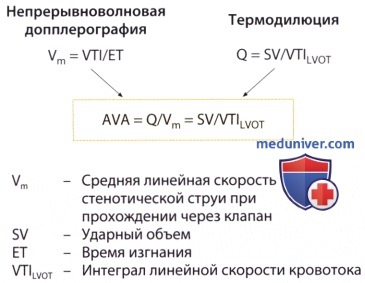
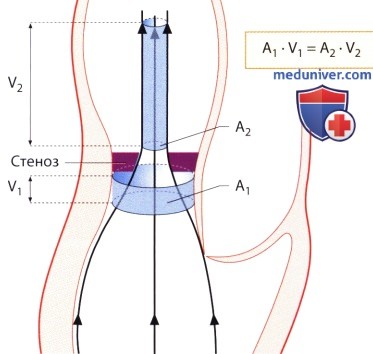
2. Уравнение непрерывности потока. Согласно уравнению непрерывности потока, выведенному из закона сохранения масс, объемная скорость тока жидкости Q в замкнутой системе трубок постоянна при любом поперечном сечении трубки. В применении к аортальному стенозу это означает, что престенотическая объемная скорость кровотока и объемная скорость ее через стенозированный участок равны, причем она равна произведению площади поперечного сечения (А) на линейную скорость кровотока (V).
3. Эффективная площадь отверстия аортального клапана. При количественной оценке аортального стеноза, когда предполагается, что аортальное отверстие круглое, диаметр выносящего тракта левого желудочка (D) равен A1 = π(D/2) 2 . Чтобы полнее использовать разрешающую способность ультразвука и точно определить место измерения клапана, исследование выполняют вдоль длинной оси сердца из парастернальной позиции датчика. Диаметр выносящего тракта левого желудочка определяют в середине систолы непосредственно проксимальнее плоскости кольца аортального клапана между межжелудочковой перегородкой и передней створкой митрального клапана; используют среднее значение 3-5 измерений. Скорость кровотока в выносящем тракте левого желудочка (V1) определяют с помощью допплеровского исследования в импульсном режиме в плоскости «пяти камер» или вдоль длинной оси сердца из апикальной позиции датчика. Соответственно позиции датчика скорость измеряют ниже плоскости аортального клапана на 0,5 см проксимальнее престенотической зоны ускорения кровотока. Наконец, измеряют еще скорость струи крови V2 c помощью непрерывноволновой допплерографии под контролем аудиосигналов. Тогда эффективную площадь отверстия аортального клапана (AVA = А2) можно определить по формуле:
Читайте также: Клапаны сердца обеспечивают движение крови в нем
Подставляя в эту формулу значения максимальной или средней скорости кровотока, можно получить значение максимальной или средней площади отверстия аортального клапана. Точность метода была проверена в ряде экспериментальных и клинических исследований. При проведении исследования опытным специалистом воспроизводимость результата определения площади отверстия аортального клапана составляет 5-8%, так что если результат при втором измерении отличается от первого результата более чем на 0,15 см 2 , например при обследовании больного в отдаленном периоде или после добутаминовой нагрузочной пробы, то разницу можно считать клинически значимой.
Наибольшие трудности при расчете площади отверстия аортального клапана с помощью уравнения непрерывности потока отмечаются при определении диаметра выносящего тракта левого желудочка, особенно при неудовлетворительных условиях проведения УЗИ. Поскольку в формуле для определения площади отверстия клапана фигурирует квадрат диаметра, то при завышении его значения на 2 мм (например, при подстановке в формулу 22 мм вместо 20 мм) значение площади получается завышенным на 21% (например, она оказывается равной 1,0 см 2 вместо 0,8 см 2 ). Есть и другая трудность: допущение о том, что сечение выносящего тракта левого желудочка является круглым, а профиль потока крови уплощенным, часто не выполняется. Поэтому в некоторых случаях, в частности у больных с неудовлетворительными условиями для УЗИ из парастернальной позиции датчика, следует воздержаться от эхокардиографического определения площади выносящего тракта левого желудочка и воспользоваться данными определения ударного объема крови методом термодилюции при зондировании правых отделов сердца.
При определении площади отверстия аортального клапана в таком случае уже используют значение ударного объема, полученное при катетеризации полостей сердца, и значение интеграла линейной скорости кровотока по времени. Такой «гибридный» способ определения площади отверстия клапана на сегодняшний день является наиболее точным и особенно целесообразен в тех случаях, когда больному и без того планируется выполнить катетеризацию правых отделов сердца.
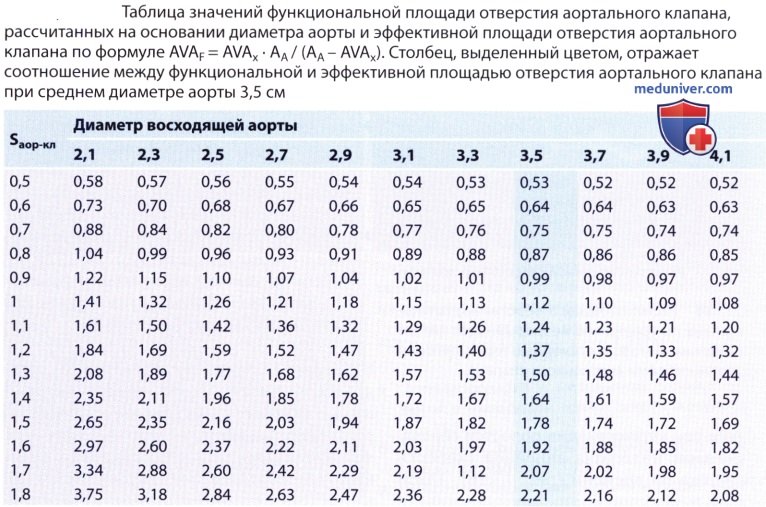
4. Функциональная площадь отверстия аортального клапана. В то время как при расчете эффективной площади отверстия аортального клапана (AVAX) из уравнения непрерывности потока описываются престенотические и стенотические динамические соотношения, для оценки функциональной значимости стеноза в целом необходимо принимать во внимание также возникновение постстенотической турбуленции потока и феномен восстановления давления. Для этого рассчитывают функциональную площадь отверстия аортального клапана (так называемый коэффициент потери энергии), т.е. дополнительно учитывают также диаметр принимающей камеры, а именно восходящей аорты (AA). Функциональную площадь отверстия аортального клапана (AVAF), которую выводят из закона сохранения импульса и массы, рассчитывают следующим образом:
Это означает, например, что:
— при AVAX, равной 1,0 см 2 , и диаметре аорты, равном 2,5 см (что соответствует площади поперечного сечения ее AA 5 см 2 ), функциональная площадь отверстия аортального клапана составляет 1,25 см 2 и
— при AVAX, равной 0,5 см 2 , и диаметре аорты 3,6 см (что соответствует площади поперечного сечения ее AA 10 см 2 ) функциональная площадь отверстия аортального клапана составляет 0,53 см 2 .
В таблице ниже отражена зависимость между эффективной и функциональной площадью отверстия аортального клапана при различных диаметрах аорты. Среднее значение диаметра аорты выведено на основании результатов клинических исследований трех авторов, проведенных в общей сложности на 175 больных: Schobel и соавт.: 3,7±0,8 см; Baumgartner и соавт.: 3,1±0,6 см; Treat и соавт.: 3,55±0,4 см.
Зная наряду с эффективной площадью отверстия аортального клапана также диаметр аорты, можно определить энергию, теряемую при прохождении струи крови через стенозированный аортальный клапан, и нагрузку на левый желудочек. Эти параметры лучше объясняют появление клинических симптомов, чем эффективная площадь отверстия аортального клапана. Так, прогрессирующее расширение аорты даже при отсутствии изменений в аортальном клапане и постоянной анатомической, или эффективной, площади отверстия аортального клапана приводит к уменьшению функциональной площади отверстия аортального клапана. Еще одним преимуществом определения функциональной площади отверстия аортального клапана является то, что этот показатель сопоставим с площадью отверстия аортального клапана, определенной по формуле Горлина, в которой также учитываются условия кровотока и гемодинамика дистальнее стеноза.
е) Дополнительные допплеровские параметры:
1. Сопротивление аортального клапана («valvular resistance»). Сопротивление аортального клапана представляет собой отношение максимального градиента давления к объемной скорости потока через клапан и основывается, в отличие от уравнения Бернулли и выведенной из него формулы Горлина, на допущении о линейной зависимости между градиентом и объемной скоростью потока. Сопротивление клапанов сердца R можно определить с помощью допплерографии, используя в случае аортального клапана формулу:
где LVOT — выносящий тракт левого желудочка (left ventricular outflow tract).
Оказалось, что этот параметр лучше описывает гемодинамику при аортальном стенозе, чем площадь отверстия аортального клапана. Однако в ряде работ было показано, что сопротивление аортального клапана не является параметром, не зависящим от потока крови, и поэтому не имеет каких-либо преимуществ перед традиционными параметрами, которые количественно характеризуют аортальный стеноз (площадь отверстия аортального клапана, градиент давления на клапане, скорость потока).
2. Дополнительная систолическая работа. Дополнительная систолическая работа (SWL от англ, stroke work loss) представляет собой параметр, предложенный для количественной характеристики аортального стеноза. Рассчитывают SWL по представленной ниже формуле, в которой не фигурируют характеристики потока крови:
где PLVSP — систолическое давление в левом желудочке.
Дополнительная систолическая работа, превышающая 25%, указывает на гемодинамически значимый аортальный стеноз и неблагоприятный прогноз. При расчете этого параметра особенности потока крови не учитываются, и в этом смысле SWL, конечно, уступает традиционному определению площади отверстия аортального клапана.
3. Отношение скоростей. Отношение скорости движения крови в выносящем тракте левого желудочка к скорости движения стенотической струи V1/V2 представляет собой упрощение уравнения непрерывности потока. Его определяют в дополнение к измерению площади отверстия аортального клапана, особенно при неудовлетворительных условиях лоцирования аорты из парастернальной позиции датчика. Значение V1/V2 меньше 0,25 указывает на гемодинамически значимый аортальный стеноз. Определение этого параметра особенно оправданно при наблюдении за больным в динамике, так как, полагая, что диаметр клапанного кольца остается постоянным, можно по соотношению скорости кровотока в выносящем тракте левого желудочка и через стенозированный клапан оценить изменение степени стеноза и гемодинамики.
4. Отношение фракции укорочения размера левого желудочка, или фракции выброса, к скорости кровотока. Для количественной оценки степени аортального стеноза предложено использовать отношение фракции укорочения (FS — Fractional Shortening) размера левого желудочка к максимальному градиенту давления, рассчитанному по упрощенному уравнению Бернулли ΔP=4V 2 . Это отношение как параметр отражает наряду со скоростью кровотока через стенозированный клапан также функцию левого желудочка, о которой судят по фракции укорочения размера левого желудочка, определяемой с помощью ЭхоКГ в М-режиме. Мнения о диагностической ценности этого параметра противоречивы.
В то время как Karpuz и соавт. для граничного значения этого параметра 0,8 показали довольно высокую чувствительность (97%) и специфичность (78%) в распознавании аортального стеноза (AVA≤0,53 см 2 /м 2 ) Otto и соавт., исследовавшие 382 больных с аортальным стенозом, выявили лишь весьма слабую корреляцию с результатами определения площади отверстия аортального клапана, рассчитанной по формуле Горлина. Фракция укорочения FS, как известно, при локальном нарушении сократительной функции миокарда желудочка бывает снижена, и, кроме того, нет тесной корреляции между фракцией укорочения FS, или глобальной сократительной функцией левого желудочка, и минутным объемом сердца, т.е. потоком крови через аортальный клапан. Этим можно объяснить слабую корреляцию с площадью отверстия аортального клапана, определенной по формуле Горлина при зондировании полостей сердца.
Учитывая перечисленные ограничения, Antonini-Canterin и соавт. предложили пользоваться модифицированным параметром, который представляет собой отношение фракции выброса левого желудочка, определенной при двумерной ЭхоКГ, к максимальной скорости кровотока. Этот параметр отражает тесную корреляцию с площадью отверстия аортального клапана, определенной при инвазивном исследовании. Однако у больных с аортальным стенозом, у которых имеется также митральная или аортальная недостаточность либо гипертрофия левого желудочка и связанное с ней уменьшение его размеров, предсказательная ценность этого параметра ограничена, так как хотя фракция выброса левого желудочка в этих случаях может быть в пределах нормы, ударный объем его снижен.
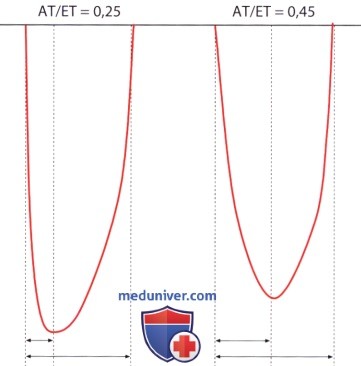
5. Отношение времени нарастания давления к периоду изгнания. Отношение времени нарастания давления в левом желудочке (АТ) к периоду изгнания (ЕТ)-АТ/ЕТ представляет собой параметр, который учитывает давно известный в клинике феномен, состоящий в том, что давление в левом желудочке при гемодинамически значимом аортальном стенозе, медленно повышаясь, достигает своего максимума лишь во второй половине систолы. При ЭхоКГ значение АТ/ЕТ, равное 0,3, является граничным; более высокие значения указывают на гемодинамически значимый аортальный стеноз. Поскольку как время нарастания давления в левом желудочке АТ, так и период изгнания зависят от функции желудочка, диагностическая ценность параметра АТ/ЕТ в отношении аортального стеноза ограничена.
ж) Значение допплер-эхокардиографии. Обобщая материал, изложенный выше, следует отметить, что ни один из названных дополнительных допплеровских параметров, предложенных для количественной оценки аортального стеноза, не имеет особого значения и по своей предсказательной ценности не превосходит традиционно определяемые параметры, в частности максимальную скорость, градиент давления и площадь отверстия аортального клапана. В некоторых случаях более предпочтительным может оказаться использование в расчетах отношения скоростей V1/V2.
1. Функциональная площадь отверстия аортального клапана. Для полной оценки изменений гемодинамики при аортальном стенозе следует определить функциональную площадь отверстия аортального клапана [так называемый коэффициент потери энергии]. Однако для этого необходимо определить весь комплекс параметров — площадь поперечного сечения выносящего тракта левого желудочка и скорость кровотока в нем, максимальную скорость стенотической струи и диаметр нисходящей аорты.
2. Эффективная площадь отверстия аортального клапана. Если диаметр восходящей аорты точно измерить из лево- или правосторонней парастернальной позиции датчика бывает невозможно, то следует рассчитать эффективную площадь отверстия аортального клапана с помощью уравнения непрерывности потока.
3. Отношение скоростей V1/V2. Если условия сканирования из парастернальной позиции оказываются неудовлетворительными и в связи с этим невозможно точно измерить размер аортального клапанного кольца, при расчетах ограничиваются отношением скорости движения крови в выносящем тракте левого желудочка к скорости движения стенотической струи V1/V2.
4. Скорость стенотической струи (V2) и градиент давления. Если невозможно точно измерить скорость кровотока в выносящем тракте левого желудочка, ограничиваются лишь определением скорости стенотической струи V2 и на ее основании рассчитывают градиент давления.
5. Качественная оценка. Если при допплерографии не удается отчетливо лоцировать стенотическую струю, независимо от того, вводится эхоконтрастный раствор или нет, то следует ограничиться лишь описанием особенностей аортального клапана (обызвествление, сепарация заслонок), левого желудочка (гипертрофия), а также результатов планиметрического определения площади отверстия аортального клапана по данным ЧПЭ.
Видео:Протезирование аортального клапанаСкачать

Видео ЭхоКГ аортального клапана — оценка, протокол исследования
Редактор: Искандер Милевски. Дата обновления публикации: 29.1.2021
💥 Видео
Возрастной стеноз аортального клапанаСкачать

Эхокардиография. Створки аортального клапанаСкачать

Заболевания клапанов сердцаСкачать

УЗИ сердца. Двустворчатый аортальный клапанСкачать

Аортальная недостаточность - "Просто о сложном"Скачать

Вопросы врачу. Аортальная недостаточностьСкачать

Основы ЭхоКГ: исследование аортального клапана.Скачать

Недостаточность аортального клапана.Скачать

Двухстворчатый аортальный клапан и физическая активностьСкачать

Эхокардиография. Фиброз аортального клапанаСкачать

Аортальный стеноз Определение тяжести по рекомендациям ASEСкачать
Аортальный стеноз. Легкий или умеренный?.Скачать

Аортальный стеноз: лечение эндоваскулярным методом трансапикальным доступомСкачать

Профилактика аортального стеноза: это возможно?Скачать

Недостаточность аортального клапана. СимптомыСкачать

Эхокардиография. Кальциноз аортального клапана. Аортальный стеноз 3 степени. Диффузный гипокинезСкачать

Порок сердца. Стеноз аортального клапана.Скачать