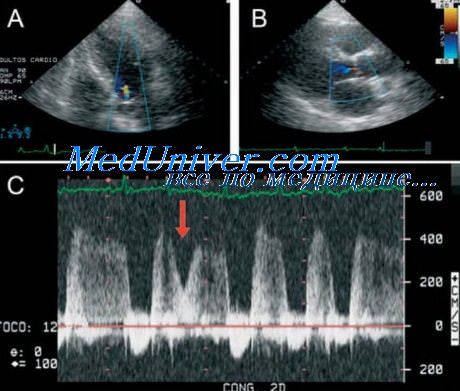
- Диастолическое расхождение створок митрального клапана норма
- Норма ЭхоКГ (эхокардиоскопии)
- Эхокардиография митрального клапана (часть 1)
- Эхокардиографическая анатомия митрального клапана
- Физиология митрального клапана
- Митральный стеноз на эхокардиографии
- Ревматический митральный стеноз на ЭхоКГ
- Пролапс митрального клапана: клинические варианты, современные представления
- ПМК как «эхокардиографическая болезнь»
- Вторичный ПМК при болезнях миокарда
- Первичный ПМК
- Вторичный ПМК при синдромных ННСТ
- ПМК как вариант нормы или проявление малой аномалии развития сердца
- 📸 Видео
Видео:Разбираем показатели вашего ЭХОКГ.Скачать

Диастолическое расхождение створок митрального клапана норма
Передняя створка митрального клапана без признаков патологии регистрируется во второй стандартной позиции датчика в виде буквы М.
Для более полного понимания и последующей трактовки параметров, отражающих механизм митрального клапана, мы считаем уместным привести описательную характеристику движения согласно схеме.
Общая экскурсия митрального клапана определяется в систолу по вертикальному смещению створок в интервале СД, диастолическое расхождение определяется по горизонтали в интервале отрезка СД. Скорость раннего диастолического открытия и закрытия рассчитывается графическим путем по описанному выше способу путем построения касательных к соответствующим участкам кривой движения митрального клапана.
Полулунные клапаны. Клапаны аорты и сама аорта лоцируются в IV стандартной позиции датчика. В диастоле клапаны регистрируются на эхокардиограмме в виде «змейки» в центре просвета аорты. Расхождение аортальных клапанов в систолу напоминает «ромбооб-разную фигуру».
Систолическое расхождение аортальных клапанов равно расстоянию между конечными их участками, обращенными в просвет аорты. Просвет аорты в систолу и диастолу определяется по очертаниям ее внутренней поверхности в соответствующие фазы сердечного цикла относительно ЭКГ.
Левое предсердие, как и аорта, регистрируется в IV стандартной позиции датчика. На эхокардиограмме регистрируется практически только задняя стенка левого предсердия. Его переднюю стенку в эхокардиографии считают совпадающей с задней поверхностью аорты. Соответственно указанным признакам и определяется размер полости левого предсердия.
Норма ЭхоКГ (эхокардиоскопии)
Средние эхокардиографические показатели в норме (по данным литературы):
Левый желудочек.
Толщина задней стенки левого желудочка в диастолу 1 см, в систолу—1,3 см.
Конечный диастолический размер полости левого желудочка — 5 см.
Конечный систолический размер полости левого желудочка — 3,71 см.
Скорость сокращения задней стенки левого желудочка — 4,7 см/с.
Скорость расслабления задней стенки левого желудочка — 10 см/с.
Митральный клапан.
Общая экскурсия митрального клапана — 25 мм.
Диастолическое расхождение митральных створок (на уровне точки Е) — 26,9в мм.
Скорость открытия переходной створки (ЕГ)—276,19 мм/с.
Скорость раннего диастолического закрытия передней стенки — 141,52 мм/с.
Длительность открытия клапана — 0,47±0,01 с.
Амплитуда открытия передней створки — 18,42±0,3& мм.
Просвет основания аорты — 2,52±0,05 см.
Размер полости левого предсердия — 2,7 см.
Конечный диастолический объем — 108 см3.
Конечный систолический объем — 58 см3.
Ударный объем — 60 см3.
Фракция изгнания — 61%.
Скорость циркулярного сокращения — 1,1 с.
Масса миокарда левого желудочка — 100—130 г.
Видео:Болезни митрального клапана. Пролапс митрального клапана, стеноз, регургитация.Скачать

Эхокардиография митрального клапана (часть 1)
Видео:Пролапс митрального клапана. Что это и как быть.Скачать

Эхокардиографическая анатомия митрального клапана
Эхокардиография впервые стала использоваться для оценки митрального клапана. Митральный клапан состоит из двух створок, фиброзного кольца, сухожильных хорд и двух сосочковых мышц. Передняя (аортальная) створка прикрепляется к корню аорты в непосредственной близости с аортальным клапаном и фиброзной перегородкой и имеет прямоугольную форму, охватывающую одну треть окружности кольца. Задняя створка продолжается с задней стенкой левого предсердия и длиннее передней створки, занимая две трети окружности митрального кольца. Задняя створка на эхокардиографии обычно делится на три гребешка, но это конфигурация может быть разной. Две створки коаптируют в зоне аппозиции, оставляя перекрывающийся сегмент длиной 5 мм.
Хордальная анатомия митрального клапана сложна, около 12 первичных хорд отходят от каждой сосочковой мышцы, заднемедиальной и переднебоковой, которые затем разделяются на вторичные и многочисленные третичные ветви, которые прикрепляются к краям двух створок. Сами сосочковые мышцы продолжаются трабекулами и субэндокардиальным слоем стенки желудочка. Нормальный диаметр митрального кольца на ЭхоКГ составляет примерно 3 см при окружности 8–9 см. Кольцо не является пассивной структурой, поэтому в дополнение к его нормальному движению к верхушке в систоле сокращение задней мышцы миокарда укорачивает диаметр кольца на 25%, что делает его динамику очень важным компонентом в механизме компетентности митрального клапана.
Физиология митрального клапана
Оптимальная функция митрального клапана зависит от целостной функции всех его компонентов: створок, хорд, фиброзного кольца и папиллярных мышц, а также состояния левого предсердия и левого желудочка. Увеличение полости левого предсердия и изменение формы приводят к дилатации митрального кольца и, следовательно, к общей дисфункции и несостоятельности клапана. Нормальный митральный клапан не закрывается пассивно. В дополнение к разнице давлений между желудочком и предсердием в систоле, сокращение кольца и сокращение сосочковых мышц играет важную роль в поддержании компетентности митрального клапана.
Площадь поперечного сечения отверстия митрального клапана составляет примерно 5,0 см2, что позволяет наполнению левого желудочка происходить преимущественно в раннюю диастолу (примерно две трети объема поступающей крови) с максимальной скоростью по эхокардиографии 50–100 см/с. Оставшаяся треть ударного объема проходит через митральный клапан во время систолы предсердий. Во время диастаза объем желудочков остается неизменным. При упражнениях и увеличении частоты сердечных сокращений диастаз укорачивается, а компоненты раннего и позднего наполнения сближаются, пока они не объединятся и не станут неразличимы на допплерографии. С возрастом картина наполнения меняется на противоположную, и доминирующее наполнение левого желудочка происходит в позднюю диастолу.
Митральный стеноз на эхокардиографии
Врожденный митральный стеноз на эхокардиографии — относительно редкая группа аномалий со значительными вариациями морфологических особенностей. Обычно в этот диагноз включаются трехпредсердное сердце (cor triatriatum) и надклапанная митральная мембрана, которые можно идентифицировать с помощью четырехкамерного и продольного срезов на ЭхоКГ. Характерно, что цветная допплерография выявляет ускорение проксимальнее створок митрального клапана. Однако нет ничего необычного в том, что надклапанный митральный стеноз связан с утолщением створок митрального клапана, а также с аномалиями хорд. Изолированный стеноз митрального клапана — редкость. Помимо утолщенных и диспластических створок, могут быть обнаружены аномалии хорд и папиллярных мышц. В классическом парашютном митральном клапане на эхокардиографии все хорды переходят в одну сосочковую мышцу.
Ревматический митральный стеноз на ЭхоКГ
Ревматический митральный стеноз поражает 10/100 000, преимущественно жителей восточного региона. Митральный стеноз прогрессивно развивается после возникновения ревматической лихорадки в детстве. Это приводит к слиянию створок за счет спаек, утолщению створок и, в конечном итоге, к фиброзу. На ранних стадиях передняя митральная створка податлива, демонстрируя возвышающееся движение в диастолу и, возможно, некоторую степень пролапса створки в систолу. Задняя створка всегда жесткая из-за спаечного сращения.
Утолщение клапана затрагивает преимущественно кончики и тело створки, но имеет тенденцию щадить ее основание. Также может быть задействован подклапанный аппарат, тогда на эхокардиографии хорды утолщены и слиты, а сосочковые мышцы покрыты рубцами из-за распространения фиброза на нижнебазальный миокард. Со временем митральное кольцо и створки могут кальцифицироваться. Длительный митральный стеноз может осложняться дилатацией левого предсердия, фибрилляцией предсердий, развитием тромба и стенокардии. Митральный стеноз также может приводить к застою легочных вен, легочной гипертензии, гипертрофии и дилатации правого желудочка, а также к функциональной трикуспидальной регургитации.
Патофизиология: По мере прогрессирования заболевания створки утолщаются, спаек сливаются, а площадь митрального клапана уменьшается. На площади 2,5 см2 симптомы начинают проявляться, поскольку на падение трансмитрального давления влияет площадь клапана, ритм, продолжительность диастаза и диастолическая функция желудочков. При площади клапана 2,5см2 пиковая скорость наполнения левого желудочка падает и диастаз теряется. В покое на эхокардиографии это не имеет физиологических последствий, но при упражнениях наполнение левого желудочка поддерживается только за счет значительного повышения давления в левом предсердии и, следовательно, падения давления между левым предсердием и левым желудочком. По мере того, как площадь клапана становится все меньше, в состоянии покоя возникает падение давления. Обычно это связано с падением сердечного выброса, повышением сопротивления легочных сосудов и ухудшением симптомов. При тяжелом митральном стенозе разница давления между левым предсердием и левым желудочком может достигать 25–30 мм рт.ст., при площади клапана менее 1 см2 по сравнению с нормальной площадью клапана 5 см2.
Увеличение частоты сердечных сокращений существенно не меняет эффективную площадь митрального отверстия по сравнению с площадью при стенозе аорты. Это можно объяснить меньшим количеством спаек, способствующих открытию клапана, по сравнению с аортальным клапаном. Поражение подклапанного аппарата фиброзом само по себе может способствовать увеличению степени стеноза. У некоторых пациентов тяжесть фиброза и сужения хорд может стать уровнем ограничения кровотока, а не кончиками створок. Важным последствием митрального стеноза является его влияние на давление в левом предсердии, размер и легочную сосудистую сеть. По мере прогрессирования заболевания и уменьшения площади клапана уменьшается опорожнение левого предсердия, увеличивается размер левого предсердия и давление, а также увеличивается давление в легочной вене.
Длительные состояния могут привести к необратимой легочной гипертензии, вторичной по отношению к повышению давления в левом предсердии. Чтобы получить независимую от потока оценку степени сужения, часто вычисляют площадь митрального клапана. Для этого был предложен ряд методов, но ни один из них не является полностью удовлетворительным. Не существует согласованного золотого стандарта, по которому можно было бы откалибровать неинвазивные меры, и при сравнении друг с другом коэффициенты корреляции обычно слишком низки, чтобы их можно было применить к отдельным пациентам. Более того, сомнительно, можно ли описать сложное гемодинамическое нарушение атриовентрикулярного кровотока простым указанием площади.
Читайте также: Пружины для клапанов ваз 21083
Видео:Эхокардиография. Створки аортального клапанаСкачать

Пролапс митрального клапана: клинические варианты, современные представления
В статье обсуждается клиническое многообразие митрального пролабирования, предполагающее неоднозначный прогноз у пациентов с пролапсом митрального клапана (ПМК) и разную тактику их ведения. Наибольшее внимание уделено первичному ПМК как единственному вари
The article covers clinical diversity of mitral prolapse, deliberating ambiguous prognosis in patients with mitral valve prolapse (MVP) and different tactics of their management. The greatest attention is paid to primary MVP as the only variant of mitral prolapse claiming nosological independence. The origin of a primary MVP as a consequence of congenital mesenchymal inferiority in the framework of hereditary connective tissue disorders is considered.
Несмотря на более чем полувековую историю изучения пролапса митрального клапана (ПМК), ряд вопросов, касающихся диагностики, определения прогноза, тактики ведения пациентов с этой патологией, продолжают вызывать затруднения у практических врачей. Во многом это связано с морфологической и клинической неоднородностью этого состояния, предполагающей существование разных вариантов митрального пролабирования.
ПМК — синдром, присущий различным нозологическим формам и всякий раз требующий нозологической верификации. Перечень болезней, проявляющихся ПМК, обширен, что объясняется сложностью строения клапанного аппарата сердца и разнообразием механизмов митрального пролабирования. В основе ПМК могут лежать изменения фиброзного кольца, створок митрального клапана и прикрепляющихся к ним хорд, дисфункция папиллярных мышц, нарушения сократимости миокарда левого желудочка.
В клинической практике ПМК может выступать в пяти ипостасях:
- первичный ПМК;
- вторичный ПМК как следствие болезней миокарда;
- вторичный ПМК как проявление наследственных моногенных синдромов;
- митральное пролабирование как вариант нормы или проявление малой аномалии развития сердца;
- ПМК как «эхокардиографическая болезнь».
ПМК как «эхокардиографическая болезнь»
ПМК как «эхокардиографическая болезнь» — ситуация ошибочной диагностики митрального пролабирования. На заре внедрения в клиническую практику двухмерной эхокардиографии ПМК диагностировался у 5–15% и даже 35% людей, подвергнутых обследованию. Столь существенная гипердиагностика была связана с ошибочным представлением о плоской конфигурации митрального клапана. Серия ультразвуковых исследований конца 1980-х гг. доказала трехмерную (седловидную) форму митрального клапанного кольца и сделала обязательной оценку из парастернальной продольной позиции. Современное определение ПМК трактует его как систолическое выбухание одной или обеих створок митрального клапана не менее 2 мм над плоскостью митрального кольца при обязательной регистрации по длинной оси сердца. Как можно заметить, в определении четко оговариваются как анатомические критерии, так и технические аспекты процедуры исследования.
Переход на единые критерии ультразвуковой диагностики и обнародование результатов Фремингемского исследования позволили устранить противоречия во взглядах на распространенность ПМК, которая оказалась существенно ниже, чем представлялось ранее. Из 3491 участника Фремингемского исследования, прошедшего двухмерную эхокардиографию по согласованным диагностическим критериям, у 47 (1,3%) был выявлен классический (с утолщением митральных створок) и у 37 (1,1%) неклассический ПМК с общей частотой 2,4% [1]. Сходные результаты получены и на материале российской популяции.
Вторичный ПМК при болезнях миокарда
В числе прочих причин ПМК может развиваться на фоне коронарной патологии, ревматизма, кардиомиопатии, миокардита, миокардиодистрофии — состояний, вызывающих нарушение сократимости миокарда левого желудочка локального или диффузного характера, дисфункцию или отрыв папиллярных мышц. Подобные варианты митрального пролабирования считаются вторичными, поскольку входят в структуру клинической картины соответствующей болезни. Наличие вторичного ПМК при отсутствии значимой митральной регургитации мало влияет на симптоматику основного заболевания. Исключение составляют случаи острой митральной недостаточности, развившейся в результате отрыва папиллярной мышцы при инфаркте миокарда или тупой травме сердца.
Первичный ПМК
Первичный ПМК — единственный вариант митрального пролабирования, претендующий на нозологическую самостоятельность. Происхождение первичного ПМК связывается с патологией створок митрального клапана, обусловленной конкретной причиной — мезенхимальной неполноценностью в рамках наследственных нарушений (дисплазий) соединительной ткани (ННСТ). ННСТ — группа генетически гетерогенных и клинически полиморфных патологических состояний, объединенных нарушением формирования соединительной ткани в эмбриональном и постнатальном периодах. Генетическая гетерогенность ННСТ подразумевает как моногенную, так и мультифакториальную природу заболевания, а клиническая полиморфность связана с повсеместным распространением в организме соединительной ткани и многообразием проявлений врожденной «слабости» ее отдельных компонентов.
В соответствии с современными представлениями выделяют две категории ННСТ: классифицируемые (имеющие согласованные рекомендации по диагностике) и неклассифицируемые (они же диспластические фенотипы). Согласованные рекомендации по диагностике имеют моногенные синдромы, обусловленные мутацией генов белков внеклеточного матрикса, рецепторов ростовых факторов и матриксных металлопротеиназ. Наиболее известными и клинически значимыми из них являются синдромы Марфана и Элерса–Данло, MASS-фенотип, синдром гипермобильности суставов и другие. К классифицируемым синдромам относится и первичный ПМК. К настоящему времени найдены ответственные за его возникновение три генных локуса, расположенные на 11-й, 13-й и 16-й хромосомах. Поиск генов, причастных к развитию митрального пролапса, продолжается, предполагается, что их идентификация создаст предпосылки для скрининга бессимптомных пациентов, угрожаемых по развитию митральной регургитации. Однако при всей привлекательности молекулярно-генетических методов исследования нельзя не отметить их малодоступность в повседневной практике. Неслучайно существующие рекомендации по ННСТ приоритет в диагностике первичного ПМК оставляют за комбинацией клинических и ультразвуковых данных.
Читайте также: Перепускной клапан гидравлический устройство
Морфологическим отражением врожденной «слабости» соединительной ткани и маркером первичного ПМК выступает так называемая миксоматозная дегенерация створок митрального клапана. Она характеризуется пролиферацией срединного — спонгиозного слоя створки с избыточным накоплением гликозаминогликанов и дезорганизацией коллагеновых фибрилл (рис. 1). При этом створка утолщается, меняет свои механические свойства, теряет способность противостоять давлению в полости левого желудочка в систолу и пролабирует.
Клиническая картина первичного ПМК разнообразна; он может быть как бессимптомным, так и клинически манифестным. Симптоматика первичного ПМК представлена комбинацией следующих синдромов:
- нарушения внутрисердечной и общей гемодинамики;
- проявления вегетативно-сосудистой дистонии;
- иные (внеклапанные) проявления «слабости» соединительной ткани.
Именно эта триада определяет клиническое своеобразие первичного ПМК, отличающее его от других вариантов митрального пролабирования. Степень выраженности каждого из указанных компонентов может быть разной, что и определяет значительный клинический полиморфизмом, присущий первичному ПМК.
Основным методом и «золотым стандартом» диагностики ПМК является двухмерная эхокардиография. Она позволяет установить факт митрального пролабирования, оценить толщину митральных створок, определить степень митральной регургитации. Указанные характеристики чрезвычайно важны в понимании тяжести состояния пациента, прогноза и тактики ведения. Так, увеличение толщины створки более 5 мм (при норме 2–4 мм) является надежным свидетельством ее миксоматозной дегенерации, представляющей собой морфологический субстрат и основной маркер первичного ПМК. В зависимости от толщины створки выделяют классический (с толщиной створки 5 мм и более) и неклассический (менее 5 мм) ПМК. Поскольку исходы ПМК определяются степенью нарушения внутрисердечной гемодинамики, не менее важным параметром выступает выраженность митральной регургитации, оцененная в ходе допплерографического исследования.
Ведущим механизмом, объясняющим многообразную симптоматику первичного ПМК, признана вегетативная дисфункция, однако наличие бессимптомных пациентов не позволяет однозначно определить ее патогенетическую роль: является ли она причиной ПМК или случайным сочетанием. Тем не менее большинство исследователей считают изменение вегетативного гомеостаза обязательным атрибутом ПМК. Именно вегетативной дисфункцией объясняются такие распространенные проявления «синдрома ПМК», как кардиалгии, большая часть сердечных аритмий, нестабильность артериального давления, липотимии, гипервентиляционный и астенический синдромы. Для объяснения распространенности вегетативной дисфункции при ПМК предложено немало гипотез, в числе которых врожденные изменения перинервия, системный дефект биологических мембран, перинатальное поражение гипоталамических структур, наконец, активно обсуждаемая последнее время версия о патогенетической роли дефицита магния.
Но как бы не были ярки проявления вегетативной дисфункции, в основе гемодинамических нарушений при ПМК лежит все же митральная регургитация. Ее неизбежным следствием становятся объемная перегрузка и дилатация левых отделов сердца, которые приводят к фибрилляции предсердий и прогрессированию сердечной недостаточности. В числе осложнений также можно назвать тромбоэмболии с миксоматозно измененных клапанов и возможность развития вторичного инфекционного эндокардита.
Причиной неблагоприятных последствий и осложнений первичного ПМК выступает не только клапанный механизм. Как было недавно показано, нарушения общей гемодинамики при данной патологии происходят не только посредством митральной недостаточности, но и через дефекты структуры и функции внеклеточного матрикса миокарда, являющиеся следствием врожденной «слабости» соединительной ткани. Указанные дефекты могут служить причиной диастолической дисфункции, снижения сократимости миокарда и развития вторичной кардиомиопатии.
В последнее время представления о тяжести последствий ПМК подверглись переоценке. Ранее ПМК считался патологией с частыми и серьезными осложнениями (включая инсульт, фибрилляцию предсердий, сердечную недостаточность) и высокой потребностью в хирургической коррекции митральной недостаточности. Вопреки прежним сведениям результаты Фремингемского исследования дали основание рассматривать ПМК как доброкачественное состояние с низкой вероятностью неблагоприятных исходов. В частности, частота фибрилляции предсердий, мозгового инсульта, синкопальных состояний у пациентов с ПМК оказалась сопоставимой с аналогичными исходами у лиц с интактными клапанами [1]. Со всей актуальностью встал вопрос о стратификации риска при ПМК. К настоящему времени выделены варианты патологии, ассоциированные с высоким риском и неблагоприятным прогнозом. Вероятность гемодинамических расстройств возрастает при высокой степени митральной регургитации и толщине створки более 5 мм, указывающей на ее миксоматозное перерождение.
Обсуждая возможные осложнения и исходы митрального пролабирования, необходимо подчеркнуть, что первичный ПМК имеет прогредиентное течение. Относясь к врожденной патологии, он тем не менее не встречается у новорожденных, характеризуется низкими показателями заболеваемости среди детей и молодых лиц и затрагивает в основном пациентов зрелого возраста. Временной интервал, предшествующий клинической манифестации ПМК, — период, в течение которого происходит нарастание миксоматозных изменений в клапанной створке вплоть до ее деформации в степени, нарушающей замыкательную функцию и ведущей к митральной регургитации. Появление последней кардинально меняет самочувствие и судьбу больных, что наглядно отражено на рис. 2, соотносящем стадийность течения ПМК с вероятностью осложнений. При этом если тромбоэмболии, инфекционный эндокардит, «функциональные» аритмии регистрируются приблизительно с одинаковой частотой в разные возрастные периоды, то частота застойной сердечной недостаточности и фибрилляции предсердий взмывает вверх после 50 лет.
Роль первичного ПМК в декомпенсации кровообращения и возникновении фибрилляции предсердий в зрелом и пожилом возрасте часто недооценивают. Манифестация клапанной патологии у пожилых больных часто становится причиной диагностических ошибок. Практические врачи слабо осведомлены о ННСТ и по сложившемуся стереотипу относят недостаточность кровообращения и нарушения сердечного ритма у лиц второй половины жизни почти исключительно на счет коронарной патологии. Нередко их не смущает ни отсутствие стенокардии или рубцовых изменений ЭКГ, ни наличие грубого систолического шума, отражающего наличие митральной регургитации.
Отдельной составляющей клинического полиморфизма первичного ПМК выступают внешние и висцеральные маркеры «слабости» соединительной ткани. Поскольку соединительнотканный дефект, лежащий в основе повышенной податливости клапанных створок, является генерализованным, признаки мезенхимальной неполноценности определяются также и со стороны кожных покровов, опорно-двигательного аппарата, внутренних органов. Известные к настоящему времени висцеральные маркеры, а также их важнейшие клинические последствия и исходы приведены в табл.
Поскольку признаки системного вовлечения соединительной ткани являются косвенным подтверждением принадлежности ПМК к ННСТ (т. е. доказательством его «первичности»), их выявление существенно с точки зрения диагностики и оценки прогноза. Так, вероятность клинически и гемодинамически значимого ПМК крайне низка у лиц, не имеющих этих признаков. В целях унификации подходов к оценке системного вовлечения соединительной ткани, в частности, определения порога стигматизации и структурирования признаков с выделением наиболее информативных, предложено использовать принятые мировым сообществом Гентские критерии (Ghent nosology, 2010) синдрома Марфана.
Последнее время характеризуется появлением новых представлений о клеточных и молекулярных механизмах первичного ПМК. Ведущая роль в механизмах возникновения первичного ПМК отводится трансформирующему β-фактору роста (TGF-β) — белку, который активирует рост фибробластов и регулирует формирование и деградацию экстрацеллюлярного матрикса. Выяснено, что целый ряд проявлений ННСТ обусловлен изменением активности TGF-β. В частности, усиленная экспрессия TGF-β обнаружена в миксоматозно измененных створках. Закономерно стремление затормозить повышенную активность TGF-β в целях предотвращения прогрессирования миксоматоза, и такие инструменты уже известны — это нейтрализующие антитела (в эксперименте), блокаторы рецепторов ангиотензина II и β-адреноблокаторы (в эксперименте и клинике). Применение этих средств открывает новые пути коррекции последствий нарушенной мезенхимальной недостаточности и, возможно, будет служить альтернативой хирургическому лечению.
Читайте также: Лада гранта натяжка ремня грм 16 клапанов
Однако реальные возможности патогенетической терапии первичного ПМК пока остаются скромными. Из относительно широко внедренных в клиническую практику способов лечения следует выделить применение препаратов магния. Патогенетическим обоснованием их применения выступает представление о первичном ПМК как клинической форме генетически обусловленного магниевого дефицита. Известно, что в условиях недостатка ионов магния синтез белков соединительной ткани замедляется, а активность ферментов, участвующих в разрушении коллагена и эластина, напротив, увеличивается. Иными словами, в условиях дефицита магния соединительная ткань разрушается быстрее, чем синтезируется.
В ряде исследований показана принципиальная возможность устранения характерной кардиальной симптоматики и ультразвуковых проявлений ПМК под влиянием препаратов магния. Одно из наиболее известных из них принадлежит коллективу отечественных авторов под руководством академика А. И. Мартынова. 6-месячный курс терапии препаратом Магнерот в дозе 3 г в сутки приводил к уменьшению глубины пролабирования и степени миксоматозной дегенерации клапанных створок. Наряду с этим была достигнута редукция клинической симптоматики, присущей данной категории больных [5]. За прошедшее время было выполнено немало сходных по дизайну исследований, в которых были получены аналогичные результаты.
Наряду с препаратами магния на роль средств патогенетического лечения первичного ПМК также могут претендовать витамины, иные микро- и макроэлементы, анаболики — препараты, имеющие отношение к метаболизму соединительной ткани и способные повлиять на биохимические механизмы, лежащие в основе миксоматозной дегенерации створки и ее пролабирования. Все они в той или иной комбинации находят применение в комплексной терапии первичного ПМК.
Обсуждая лечение ПМК, необходимо четко представлять, что гемодинамически значимое (сопровождающееся признаками сердечной недостаточности) пролабирование — порок сердца, требующий хирургической коррекции. Такие больные должны быть своевременно направлены к кардиохирургу для решения вопроса о протезировании или пластике митрального клапана. Комментируя показания к хирургическому лечению митральной недостаточности, отметим, что современные рекомендации AHA/ACC2014 не подтверждают целесообразность хирургического лечения лишь пациентов с сохраненными фракцией выброса и размером левого желудочка.
Вторичный ПМК при синдромных ННСТ
ПМК может встречаться при моногенных дефектах соединительной ткани, таких как синдромы Марфана, Лоеса–Дитца, Элерса–Данло, несовершенный остеогенез, эластическая псевдоксантома. На его долю приходится 0,25–2% случаев митрального пролабирования. Среди всех моногенных синдромов ПМК наиболее часто наблюдается при синдроме Марфана — 75% случаев (а более тяжелые варианты с миксоматозом клапанов — 28%) [6]. Распространенность ПМК у больных с синдром Элерса–Данло значительно ниже — 6% [7]. ПМК при моногенных ННСТ относится к вторичным, поскольку входит в структуру клинико-морфологических проявлений соответствующей патологии. Однако он характеризуется такими же миксоматозными изменениями клапанов, как и первичный ПМК, и этим схож с ним.
ПМК как вариант нормы или проявление малой аномалии развития сердца
Пограничная степень пролабирования, отсутствие миксоматозного утолщения створок, значимой митральной регургитации и семейного анамнеза позволяют рассматривать ПМК как вариант нормы, преходящий возрастозависимый феномен или малую аномалию сердца. Именно такие случаи митрального пролабирования наиболее часто встречаются в клинической практике, особенно у подростков, субтильных юношей, девушек и молодых женщин, создавая впечатление о чрезвычайной распространенности ПМК в популяции.
В числе причин подобных «невинных» случаев ПМК называют врожденные микроаномалии архитектуры митрального комплекса, асинергию сокращения и расслабления миокарда, нарушение клапанной иннервации и др. Отдельно следует отметить случаи неглубокого, проходящего с возрастом бессимптомного пролабирования, возникающие в пубертатном периоде в связи с неравномерным развитием отдельных элементов клапанного митрального комплекса и их неполным функциональным соответствием друг другу. При этом площадь хордально-створчатого аппарата оказывается избыточной, как бы заготовленной впрок. По окончании периода полового созревания по мере увеличения объема и массы миокарда левого желудочка указанное несоответствие нередко нивелируется (причем у женщин в меньшей степени, чем у мужчин, что, очевидно, объясняет преобладание женщин среди пациентов с ПМК).
Необходимо отдавать отчет в том, что в отсутствие данных молекулярно-генетического исследования достоверно исключить доклиническую стадию первичного ПМК во всех этих случаях не представляется возможным, что оправдывает рекомендации по динамическому наблюдению таких пациентов.
Минуло полвека с момента первого описания ПМК J. В. Barlow, установившему связь позднесистолического шума с митральной регургитацией. К каким итогам мы пришли за это время, какие выводы можем сделать?
- ПМК — синдром, присущий разным нозологическим формам и в каждом случае требующий установления нозологического диагноза.
- Установлены четкие диагностические критерии ПМК, которых следует придерживаться.
- Неоднозначность прогноза при ПМК диктует необходимость стратификации факторов риска.
- Несмотря на возможности молекулярно-генетических методов исследований диагностика ПМК продолжает оставаться синтезом клинических и ультразвуковых проявлений с оценкой признаков системного вовлечения соединительной ткани.
- Достижения в понимании механизмов развития миксоматоза открывают новые перспективы лечения первичного ПМК.
В заключение напомним, что и Всероссийское научное общество терапевтов, и Российское кардиологическое общество выпустили серию рекомендаций, посвященных диагностике и лечению ННСТ и ПМК. Обратившись к этим документам, практический врач может уточнить детали, которые не были в достаточной мере освещены в настоящей статье.
- Freed L. A., Levy D., Levine R. A. et al. Prevalence and clinical outcome of mitral-valve prolapse // N. Engl. J. Med. 1999; 341 (1): р. 1–7.
- Sainger R., Grau J. B., Branchetti E. et al. Human myxomatous mitral valve prolapse: role of bone protein 4 in valvular interstitial cell activation // J. Cell. Physiol. 2012; 227 (6): р. 2595–2604.
- Boudoulas K. D., Boudoulas H. Floppy mitral valve (FMV)/mitral valve prolapse (MVP) and the FMV/MVP syndrome: pathophysiologic mechanisms and pathogenesis of symptoms // Cardiology. 2013; 126 (2): р. 69–80.
- Delling F. N., Vasan R. S. Epidemiology and pathophysiology of mitral valve prolapse: new insights into diseaseprogression, genetics and molecular basis // Circulation. 2014; 129 (21): р. 2158–2170.
- Мартынов А. И., Акатова Е. В., Николин О. П. Результаты длительной терапии оротатом магния у пациентов с пролапсом митрального клапана // Кардиоваскулярная терапия и профилактика. 2012; 11 (3): с. 30–35.
- Taub C. C., Stoler J. M., Perez-Sanz T. et al. Mitral valve prolapse in Marfan syndrome: an old topic revisited // Echocardiography. 2009; 26 (4): р. 357–364.
- Dolan A. L., Mishra M. B., Chambers J. B., Grahame R. Clinical and echocardiographic survey of the Ehlers-Danlos syndrome // Br. J. Rheumatol. 1997; 36 (4): р. 459–462.
А. В. Клеменов, доктор медицинских наук
ГБУЗ НО ГКБ № 30, Нижний Новгород
Пролапс митрального клапана: клинические варианты, современные представления/ А. В. Клеменов
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 65-69
Теги: сердце, митральное пролабирование, врожденная мезенхимальная неполноценность
📸 Видео
Пролапс митрального клапана: лечить или нет?Скачать

Митральный клапан Эхокардиографическая оценкаСкачать

ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА: НОРМА ИЛИ ПАТОЛОГИЯ? К АРМИИ ГОДЕН?! #пролапсмитральногоклапанаСкачать

ЭхоКГ. Створки и сегменты митрального клапанаСкачать

Эхокардиография. Миксоматозная дегенерация створок митрального клапана. Пролапс створок МК.Скачать

Эхокардиографическая диагностика митрального стенозаСкачать

УЗИ сердца. Двустворчатый аортальный клапанСкачать

Пролапс митрального клапана? Двустворчатый аортальный клапан. Уа 17 лет. Хочет в ВДВ, пустят?Скачать

ОСНОВЫ ЭХОКАРДИОГРАФИИ. Митральный стенозСкачать

УЗИ сердца пролапс который не пролапс.Скачать

Болезни аортального клапана: аортальный стеноз, недостаточность аортального клапана.Скачать

Эхокардиография в диагностике и ведении пороков митрального клапана сердцаСкачать

Приобретенные пороки сердца – эхокардиографическая диагностикаСкачать

Протезирование аортального клапанаСкачать

Злокачественный аритмогенный пролапс митрального клапана – частая недооцененная проблема ЭхоКГСкачать

Этого вы не знали | Лучше проверитьсяСкачать



.png)
.png)