Митральный клапан находится между левым предсердием и левым желудочком. Он представляет собой сложный природный механизм и состоит из двух створок — тонких пластинок, которые, как паруса шхуны, управляются сетью канатов и канатиков, начинающихся от головок небольших сосочковых мышц стенки левого желудочка. Эти канатики называют хордами. Сосочковые мышцы, хорды и створки — единый аппарат, благодаря точной и скоординированной работе которого открывается и закрывается с каждым сокращением сердца «шлюз» митрального отверстия.
- Изолированные врожденные пороки
- Пролапс митрального клапана
- Дисплазия митрального клапана у плода
- ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
- Синдром соединительнотканной дисплазии сердца у детей
- 🎥 Видео
Изолированные врожденные пороки
Гораздо чаще митральный клапан поражается в случаях перенесенного эндокардита или ревматизма, и эти, уже не врожденные причины, следует исключить в первую очередь.
Пролапс митрального клапана
Врожденная недостаточность митрального клапана, которая вызывала бы необходимость раннего обращения к кардиохирургам, исключительная редкость. Но один из самых частых кардиологических диагнозов в последнее время касается его непосредственно. Это — пролапс митрального клапана. Как правило, диагноз ставится у совершенно бессимптомного ребенка при случайном осмотре на основании небольшого шума, который раньше называли «функциональным шумом в сердце» и особого внимания не обращали. С появлением и внедрением эхокардиографии причины этого шума стали понятнее. Чаще всего он вызван неточным смыканием друг с другом створок клапана, в результате чего струйка крови в момент сокращения желудочка поступает назад, просачивается в предсердие. Это может быть вызвано тем, что один из участков створки под давлением прогибается назад, «пролабирует» в сторону предсердия и пропускает эту струйку. Это и есть пролапс. Cтепень пролапса митрального клапана может быть разной — от незначительной до выраженной регургитации (обратного тока). Эта степень хорошо видна на эхокардиограммах. Если такой диагноз поставлен вашему ребенку, то не следует ни пугаться, ни автоматически считать его «сердечным больным». Пока это только «эхокардиографический» диагноз и, если нет никаких признаков сердечной недостаточности, то ваш ребенок практически здоров и может делать все, что делают дети его возраста. Надо только особенно внимательно относится к его простудам, ангинам, кариозным зубам — чтобы они не вызвали инфицирование и митрального клапана, вероятность поражения которого у ребенка с пролапсом выше, чем у других детей. Обо всем этом вам скажет кардиолог.
Видео:Болезни трикуспидального клапана. Пролапс, стеноз, регургитация.Скачать

Дисплазия митрального клапана у плода
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
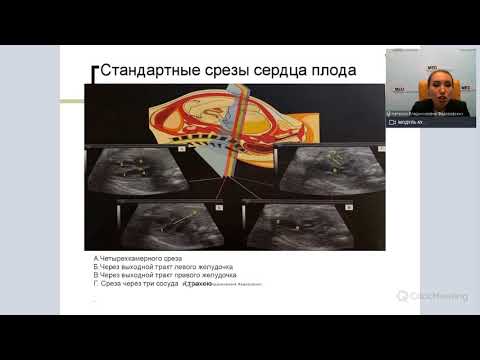
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Читайте также: Расчет пропускной способности регулирующего клапана для жидкости
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
Сочетание ВПС с патологией других органов
Сроки выявления ВПС (неделя беременности), исход
1. Перимембранозный дефект межжелудочковой перегородки
Видео:Борис Тодуров: чем опасны пороки клапанов сердца и как их распознать? ► О пороках сердца #5Скачать

Синдром соединительнотканной дисплазии сердца у детей
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки.
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки. По современным представлениям синдром соединительнотканной дисплазии определяют как самостоятельный синдром полигенно-мультифакториальной природы, проявляющийся внешними фенотипическими признаками в сочетании с диспластическими изменениями соединительной ткани и клинически значимой дисфункцией одного или нескольких внутренних органов (В. А. Гаврилова, 2002).
Под термином «дисплазия соединительной ткани сердца» (ДСТС) подразумевается аномалия тканевой структуры, в основе которой лежит генетически детерминированный дефект синтеза коллагена. Синдром ДСТС был выделен в самостоятельную нозологическую форму на симпозиуме в г. Омске (1990), посвященном проблеме врожденной дисплазии соединительной ткани. Проблема синдрома ДСТС привлекает к себе внимание в связи с большим риском развития таких осложнений, как нарушения ритма и проводимости сердца, инфекционный эндокардит, тромбоэмболия различных сосудов и внезапная сердечная смерть.
Высокая частота синдрома ДСТС при различных заболеваниях свидетельствует о системности поражения, что связано с «вездесущностью» соединительной ткани, составляющей строму всех органов и тканей.
Диспластическое сердце — сочетание конституциональных, топографических, анатомических и функциональных особенностей сердца у человека с дисплазией соединительной ткани (ДСТ). В западной литературе используется термин «миксоидная болезнь сердца» (Morales A. B., Romanelli B. E. A., 1992), однако эта формулировка используется преимущественно зарубежными авторами.
Частота диспластического сердца составляет 86% среди лиц с первичной недифференцированной ДСТ (Г. Н. Верещагина, 2008).
Читайте также: Клапан адсорбера поло седан cwva
По современным представлениям к синдрому ДСТС относят пролапсы клапанов сердца, аневризмы межпредсердной перегородки и синусов Вальсальвы, эктопически крепящиеся хорды митрального клапана и многие другие.
В основе патологии лежит неполноценность внеклеточного матрикса, его коллагеновых структур.
Диспластическое сердце формируют:
I. Конституциональные особенности — «капельное», «висячее» сердце, поворот его вокруг сагиттальной и продольной оси.
II. Костно-вертебральные дисплазии и деформации со сдавлением, ротацией, смещением сердца и перекрутом крупных сосудов: по данным Урмонаса В. К. и др. (1983). Деформации грудной клетки и позвоночника приводят к развитию торако-диафрагмального синдрома, ограничивающего работу всех органов грудной клетки.
III. Особенности строения сердца и сосудов:
IV. Патология органов дыхания со снижением жизненной емкости легких:
Миксоматозная дегенерация створок, хорд, подклапанных структур — генетически детерминированный процесс разрушения и утраты архитектоники коллагеновых и эластических структур соединительной ткани с накоплением в рыхлом фиброзном слое кислых мукополисахаридов. При этом признаки воспаления отсутствуют. В основе — дефект синтеза коллагена III типа, что приводит к истончению фиброзного слоя, створки увеличены, рыхлые, избыточные, края закручены, иногда определяется бахрома. Первичный локус аутосомно-доминантного миксоматоза при ПМК локализован в хромосоме 16. Morales A. B. (1992) выделяет миксоидную болезнь сердца.
В популяционных исследованиях феномен ПМК выявлен у 22,5% детей в возрасте до 12 лет. У детей с ДСТ ПМК обнаруживается значительно чаще — у 45–68%.
Клинические проявления ПМК у детей варьируют от минимальных до значительных и определяются степенью соединительнотканной дисплазии сердца, вегетативными и психоневрологическими отклонениями.
Большинство детей старшего возраста жалуются на кратковременные боли в грудной клетке, сердцебиение, одышку, ощущение перебоев в сердце, головокружение, слабость, головные боли. Боли в сердце дети характеризуют как колющие, давящие, ноющие и ощущают в левой половине грудной клетки без какой-либо иррадиации. Они возникают в связи с эмоциональным напряжением и сопровождаются, как правило, вегетативными нарушениями: неустойчивым настроением, похолоданием конечностей, сердцебиением, потливостью, проходят самопроизвольно или после приема седативных средств. Отсутствие в большинстве случаев ишемических изменений в миокарде по данным комплексного обследования позволяет расценить кардиалгии как проявление симпаталгии, связанной с психоэмоциональными особенностями детей с ПМК. Кардиалгии при ПМК могут быть связаны с региональной ишемией папиллярных мышц при их чрезмерном натяжении. С нейровегетативными нарушениями также связаны сердцебиение, ощущение «перебоев» в работе сердца, «покалывание», «замирание» сердца. Головные боли чаще возникают при переутомлении, переживаниях, в утренние часы перед началом занятий в школе и сочетаются с раздражительностью, нарушением сна, тревогой, головокружением.
При аускультации характерными признаками пролапса митрального клапана являются изолированные щелчки (клики), сочетание щелчков с позднесистолическим шумом, изолированный позднесистолический шум, голосистолический шум.
Происхождение шума связано с турбулентным током крови, связанным с выбуханием створок и вибрацией натянутых хорд. Позднесистолический шум выслушивается лучше в положении лежа на левом боку, усиливается при проведении пробы Вальсальвы. Характер шума может меняться при глубоком дыхании. На выдохе шум усиливается и иногда приобретает музыкальный оттенок. Нередко сочетание систолических щелчков и позднего шума наиболее отчетливо выявляется в вертикальном положении после физической нагрузки. Иногда при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
Голосистолический шум при первичном пролапсе митрального клапана наблюдается редко и свидетельствует о наличии митральной регургитации. Этот шум занимает всю систолу и практически не меняется по интенсивности при перемене положения тела, проводится в подмышечную область, усиливается при проведении пробы Вальсальвы.
Основными методами диагностики ПМК являются двухмерная Эхо-КГ и допплерография. ПМК диагностируют при максимальном систолическом смещении створок митрального клапана за линию кольца митрального клапана в парастернальной продольной позиции на 3 мм и более. Наличия изолированного смещения передней створки за линию кольца митрального клапана в четырехкамерной верхушечной позиции недостаточно для диагностики ПМК, это служит основной причиной его гипердиагностики.
Эхо-КГ-классификация миксоматозной дегенерации (МД) (Г. И. Сторожаков, 2004):
Степень регургитации при ПМК зависит от наличия и выраженности миксоматозной дегенерации, количества пролабирующих створок и глубины пролабирования.
В состоянии покоя митральная регургитация (МР) первой степени диагностируется у 16–20%, вторая степень — у 7–10% и третья степень — у 3–5% детей с ПМК.
Прогноз больного с ПМК определяет степень митральной регургитации. При этом любая степень пролабирования приводит к изменениям перфузии миокарда, изменениям чаще в области передней стенки ЛЖ и межжелудочковой перегородки (Нечаева Г. И., Викторова И. А., 2007)).
Тяжелые осложнения при ПМК у детей встречаются нечасто. Ими являются: жизнеугрожаемые аритмии, инфекционный эндокардит, тромбоэмболия, острая либо хроническая митральная недостаточность и даже внезапная смерть.
Острая митральная недостаточность возникает из-за отрыва сухожильных нитей от створок митрального клапана (синдром «болтающегося» клапана — loppy mitral valve), в детском возрасте наблюдается казуистически редко и в основном связана с травмой грудной клетки у больных на фоне миксоматозной дегенерации хорд. Основным патогенетическим механизмом острой митральной недостаточности является легочная венозная гипертензия, возникающая из-за большого объема регургитации в недостаточно растяжимое левое предсердие. Клиническая симптоматика проявляется внезапным развитием отека легких.
У детей митральная недостаточность при ПМК протекает чаще всего бессимптомно и диагностируется при допплерэхокардиографическом исследовании. В последующем при прогрессировании регургитации появляются жалобы на одышку при физической нагрузке, снижение физической работоспособности, слабость, отставание в физическом развитии.
Факторами риска развития «чистой» (не воспалительной) митральной недостаточности при синдроме пролабирования по данным двухмерной эхокардиографии являются:
ПМК является высоким фактором риска возникновения инфекционного эндокардита. Абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза.
Диагностика инфекционного эндокардита при ПМК представляет определенные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита играют: 1) клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, и другие симптомы), 2) появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Частота внезапной смерти при синдроме ПМК зависит от многих факторов, основными из которых являются электрическая нестабильность миокарда при наличии синдрома удлиненного интервала QT, желудочковых аритмий, сопутствующая митральная недостаточность, нейрогуморальный дисбаланс.
Риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз.
В большинстве случаев внезапная смерть у больных с ПМК носит аритмогенный генез и обусловлена внезапным возникновением идиопатической желудочковой тахикардии (фибрилляции) или на фоне синдрома удлиненного интервала QT.
В редких случаях в основе внезапной сердечной смерти у больных с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу.
Читайте также: 1jz fse клапан vvti
Таким образом, основными факторами риска внезапной смерти у детей с синдромом ПМК являются: желудочковые аритмии III–V градации по Lown; удлинение корригированного интервала QT более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки; кардиогенные обморочные состояния в анамнезе.
ДСТС являются одними из неблагоприятных факторов, предрасполагающих к развитию аритмических осложнений в детском и подростковом возрасте, в том числе гемодинамически значимых. В структуре нарушений ритма у детей с ДСТС чаще выявляются наджелудочковая экстрасистолия в патологическом количестве и желудочковая экстрасистолия, взаимосвязанные со степенью кардиальной дисплазии (Гнусаев С. Ф., соавт., 2006).
Морфологическими проявлениями синдрома ДСТС у детей с сопутствующей патологией почек, по данным Домницкой Т. М., Гавриловой В. А. (2000), являются: шаровидная или треугольная форма сердца, закругление верхушки сердца, увеличение массы сердца в 1,4–2,5 раза, утолщение и укорочение хорд митрального клапана, отхождение хорд в виде веера, гипертрофия сосочковых мышц, воронкообразная форма митрального клапана, открытое овальное окно. Миксоматозная дегенерация створок атриовентрикулярных клапанов наблюдалась у большинства больных с синдромом ДСТС и заболеваниями органов мочевой системы (частота ее колебалась от 66,7% до 77%). Фиброэластоз эндокарда был выявлен у 10 детей анализируемой группы.
В популяции детей наиболее часто выявлялись смещение септальной створки трехстворчатого клапана в полость желудочка в пределах 10 мм, нарушенное распределение хорд передней створки митрального клапана, дилятация синусов Вальсальвы, увеличенная евстахиева заслонка более 1 см, дилятация ствола легочной артерии, ПМК, диагонально расположенные трабекулы в полости левого желудочка.
Тактика ведения детей с первичным ПМК различается в зависимости от степени выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений. Основными принципами лечения являются: 1) комплексность; 2) длительность; 3) учет направленности функционирования вегетативной нервной системы.
Обязательным является нормализация труда, отдыха, распорядка дня, соблюдение правильного режима с достаточным по продолжительности сном.
Вопрос о занятиях физкультурой и спортом решается индивидуально после оценки врачом показателей физической работоспособности и адаптивности к физической нагрузке. Большинство детей при отсутствии митральной регургитации, выраженных нарушений процесса реполяризации и желудочковых аритмий удовлетворительно переносят физическую нагрузку. При наличии врачебного контроля им можно вести активный образ жизни без каких-либо ограничений физической активности. Детям можно рекомендовать плавание, лыжи, коньки, катание на велосипеде. Не рекомендуются спортивные занятия, связанные с толчкообразным характером движений (прыжки, борьба каратэ и др.). Обнаружение у ребенка митральной регургитации, желудочковых аритмий, изменений обменных процессов в миокарде, удлинения интервала QT диктует необходимость ограничения физической активности и занятий спортом. Этим детям разрешается занятие лечебной физкультурой под контролем врача.
Лечение строится по принципу общеукрепляющей и вегетотропной терапии. Весь комплекс терапевтических мероприятий должен строиться с учетом индивидуальных особенностей личности больного и функционального состояния вегетативной нервной системы.
Важной частью комплексного лечения детей с ДСТС является немедикаментозная терапия: психотерапия, аутотренинг, физиотерапия (электрофорез с магнием, бромом в области верхнешейного отдела позвоночника), водные процедуры, иглорефлексотерапия, массаж позвоночника. Внимание врача должно быть направлено на санацию хронических очагов инфекции, по показаниям проводится тонзиллэктомия.
Медикаментозная терапия должна быть направлена на: 1) лечение вегетативно-сосудистой дистонии; 2) предупреждение возникновения нейродистрофии миокарда; 3) психотерапию; 4) антибактериальную профилактику инфекционного эндокардита.
При умеренных проявлениях симпатикотонии назначается фитотерапия седативными травами, настойка валерианы, пустырника, сбор трав (шалфей, багульник, зверобой, пустырник, валериана, боярышник), обладающий одновременно легким дегидратационным эффектом. При наличии изменений процесса реполяризации на ЭКГ, нарушениях ритма проводятся курсы лечения препаратами, улучшающими обменные процессы в миокарде (панангин, карнитин, Кудесан, витамины). Карнитин назначают в дозе 50 мг/кг в сутки на 2–3 мес. Карнитин выполняет центральную роль в липидном и энергетическом обмене.
Являясь кофактором бета-окисления жирных кислот, он переносит ацильные соединения (жирные кислоты) через митохондриальные мембраны, предупреждает развитие нейродистрофии миокарда, улучшает его энергетический обмен. В наших исследованиях 35 детям с экстрасистолией (более 15 в одну минуту) в состав комплексной терапии был включен карнитин. По окончании лечения у 25 детей экстрасистолия значительно уменьшилась, у 10 детей — не определялась.
Отмечен благоприятный эффект от применения препарата Коэнзим Q10®, который значительно улучшает биоэнергетические процессы в миокарде и особенно эффективен при вторичной митохондриальной недостаточности.
Ранняя диагностика ДСТ у детей позволяет осуществлять соответствующую реабилитационную терапию и предотвращать прогрессирование заболевания. Одним из наиболее ярких терапевтических результатов является эффективное лечение детей с ДСТ (главным образом с ПМК) при помощи магнийсодержащего препарата магния оротата — Магнерот®. Выбор препарата был обусловлен известными свойствами иона магния, отмечающимися у антиаритмических препаратов I и IV класса (мембраностабилизирующие и антагонисты кальция), а также отсутствием побочных эффектов, которые могут появляться при применении традиционной антиаритмической терапии. Учитывалось также и то, что действующим веществом препарата является магния оротат, который, индуцируя синтез протеинов, участвуя в обмене фосфолипидов, являющихся составной частью клеточных мембран, необходим для фиксации внутриклеточного магния (Громова О. А., 2007).
Препарат Магнерот® применялся в виде монотерапии в дозе 40 мг/кг в сутки в течение первых 7 дней приема, затем по 20 мг/кг в сутки в течение 6 месяцев. Результатом лечения явилось уменьшение на 20–25% глубины пролабирования створок митрального клапана и уменьшение степени регургитации на 15–17%. Терапия препаратом Магнерот® не влияла на размеры левых отделов сердца и сократимость миокарда, показатели которых до лечения находились в пределах нормы.
В исследованиях, проведенных Е. Н. Басаргиной (2008), выявлен антиаритмический эффект препарата Магнерот®. При проведении суточного мониторирования ЭКГ у детей 2-й и 3-й групп было отмечено уменьшение количества желудочковых комплексов на 50% и более у 18 (27,7%) больных. Причем у 6 детей отмечено исчезновение желудочковой аритмии или уменьшение количества желудочковых комплексов до 30–312 за сутки. У 14 (21,5%) детей количество желудочковых комплексов уменьшилось не менее чем на 30%. У двух больных отмечено увеличение количества желудочковых экстрасистол до 30% от исходного уровня. Таким образом, антиаритмическая эффективность препарата Магнерот® составила 27,7%. Подобные результаты ранее получены и в других исследованиях (Домницкая Т. М. и соавт., 2005).
В то же время редкие суправентрикулярные и желудочковые экстрасистолы, если не сочетаются с синдромом удлиненного интервала QT, как правило, не требуют назначения каких-либо антиаритмических препаратов.
Таким образом, дети с синдромом ДСТС нуждаются в своевременной диагностике с использованием допплерэхокардиографии, электрокардиографии, в ряде случаев суточного мониторирования ЭКГ, назначении индивидуальной терапии и наблюдении детским кардиологом.
Терапия препаратом Магнерот® у детей с синдромом ДСТС приводит к уменьшению признаков пролапса клапанов, частоты выявления митральной регургитации, уменьшению выраженности клинических проявлений вегетативной дисфунуции, частоты желудочковых аритмий, сопровождается повышением уровня внутриэритроцитарного магния.
🎥 Видео
Пролапс митрального клапана. Симптомы и лечениеСкачать

Доктор БОКЕРИЯ. Врожденные пороки сердцаСкачать

Врожденный аортальный стеноз от плода до подростка - Ткачев Иван ВладимировичСкачать

Врожденные пороки сердца. Советы родителям - Союз педиатров России.Скачать

Дисплазия трикуспидального клапана и новообразование основания сердцаСкачать

Пролапс митрального клапана: лечить или нет?Скачать

Болезни митрального клапана. Пролапс митрального клапана, стеноз, регургитация.Скачать

Пролапс митрального клапана. Что это и как быть.Скачать

Пролапс митрального клапана🫀Скачать

Болезни аортального клапана: аортальный стеноз, недостаточность аортального клапана.Скачать

Доктор БОКЕРИЯ. Врождённый порок сердцаСкачать

Открытый артериальный проток. Врожденные пороки сердца.Скачать

Врожденные пороки сердца - Доктор рекомендуетСкачать

Патология сердца у плода. Узи в первом триместре беременностиСкачать

Недостаточность митрального клапана. Симптомы, диагностика и лечениеСкачать

Вопросы врачу. Двустворчатый аортальный клапанСкачать

Бесплатный вебинар «УЗИ сердца плода в ежедневной практике врача УЗД».Скачать
Пролапс митрального клапана#shortsСкачать




