161. Определить массу молекулы водорода, если молярная масса водорода равна 2 г/моль.
162. Сколько атомов содержится в гелии массой 250 г? Молярная масса гелия равна 4 г/моль.
163. Найти среднеквадратичную скорость молекул водорода при температуре 17 °С. Молярная масса водорода равна 2 г/моль.
164. Известно, что абсолютная температура газа уменьшилась в 4 раза. Во сколько раз изменилась средняя квадратичная скорость теплового движения молекул?
165. При сжатии неизменного количества газа его объем уменьшился в 2 раза, а давление увеличилось в 2 раза. Во сколько раз изменилась при этом его температура?
166. Какое давление рабочей смеси установится в цилиндрах двигателя внутреннего сгорания, если к концу такта сжатия температура повысилась с 47 до 367 °С, а объем уменьшился с 1,8 до 0,3 л ? Первоначальное давление было равно 10 кПа.
167. Газ, находившийся в баллоне объемом 10 л под давлением 1МПа при 300 К, перекачали в другой баллон емкостью 5 л и охладили до 250 К. Каким стало давление в этом баллоне?
168. Во сколько раз изменится плотность идеального газа при понижении температуры от 127 до 7 °С, если давление останется постоянным?
169. Сколько молекул находится в комнате объемом 80 м 3 при температуре 17 °С и давлении 10 5 Па ?
170. Найти среднеквадратичную скорость молекул газа, если его плотность 2 кг/м 3 ,а давление– 120 кПа.
171. В межзвездном пространстве находится
1 атом водорода в 1 см 3 . Температура газа 125 К. Определить давление межзвездного газа.
172. При изотермическом расширении газа его объем увеличился с 4 л до 12 л, а давление уменьшилось на 80 кПа. Найти начальное давление газа.
173. При изотермическом сжатии газа его давление увеличилось в 2 раза, а объем уменьшился на 5 л. Найти начальный объем газа.
174. В баллоне находится газ при температуре 15 °С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 градусов ?
175. Идеальный газ находится в закрытом сосуде постоянного объема. При нагревании газа на 200 °С его давление увеличилось в 1,4 раза. Найдите первоначальную температуру газа.
176. Определите массу 12 л углекислого газа, находящегося под давлением 900кПа и температуре 288 К. Молярная масса равна 44 г/моль.
177. Определите плотность азота при температуре 27 0 С и давлении 100кПа. Молярная масса азота равна 28г/моль.
178. В закрытом сосуде находится газ под давлением 500 кПа. Какое давление установится в сосуде, если 4/5 массы газа выйдет наружу? Температуру считать постоянной.
179. Сколько молекул содержится в газе объемом 2 м 3 при давлении 150кПа и температуре 27°С?
180. Баллон вместимостью 40 л содержит 1,98 кг углекислого газа. Баллон выдерживает давление не выше 3×10 6 Па. При какой температуре возникнет опасность взрыва? Молярная масса углекислого газа 44 г/моль.
181. Определите температуру азота, имеющего массу 2г и занимающего объём 830 см 3 при давлении 0,2 МПа. Молярная масса азота равна 28 г/моль.
182. Идеальный газ, количество которого 0,3 моля, совершает процесс b — c, изображенный на рисунке 33. Найти начальную и конечную температуры газа.
183. Сосуд, из которого выкачан воздух, соединяют с баллоном, содержащим воздух. В результате устанавливается давление 2×10 5 Па. Определите давление воздуха в баллоне до соединения, если объем сосуда в три раза больше объема баллона. Процесс происходит при постоянной температуре.
| Рис. 33 |
184. Газ с начальной массой 160 г и температурой 27 °С нагревают в сосуде, снабженном клапаном, так что давление газа остается постоянным. Если при нагревании из сосуда ушла часть газа массой 40 г, то абсолютная температура изменилась на ¼°C.
185. В сосуде емкостью 4 л находится газ под давлением 6×10 5 Па. Газ изотермически расширяется до объема 12 л. Затем при изохорическом нагревании его температура увеличивается в три раза. Найдите давление газа в конце процесса.
186. При изотермическом сжатии объём газа уменьшился с 10 до 6 л, а давление возросло на 5 кПа. Определить первоначальное давление газа.
187. На сколько процентов увеличится объём газа, если при постоянном давлении его нагреть от 27 до 87 °С?
188. Баллон содержит сжатый воздух объемом 40 л под давлением 15МПа. Какой объем воды можно вытеснить из цистерны подводной лодки воздухом из этого баллона, если лодка находится на глубине 20 м?
189. Цилиндрический горизонтально расположенный сосуд длиной 85см делится на две части подвижным невесомым поршнем (рис. 34). Если в одну часть сосуда поместить водород (m1 = 2г/моль), а в другую ¾ такую же массу кислорода (m2 = 32 г/моль), то поршень будет на расстоянии¼см от стенки сосуда.
Видео:Давление газаСкачать
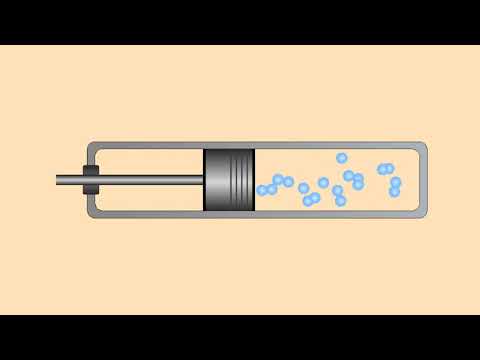
Газ с начальной массой m = 160 г и температурой Т= 373 К нагревают в сосуде объемом 120 л, снабженном клапаном, так что давление газа остается постоянным.
Расширение сосуда при нагревании пренебрежимо мало. При нагревании из сосуда ушла часть газа массой Δm = 20 г, и абсолютная температура газа изменилась на
Воздух в закрытом сосуде , т.е объём — Const => процесс изохорный :p1/p2=T1/T2T1=20+273K=293KT2=60+273=333K p1- атмосферное давление = 101.325 Па
Видео:Урок 46 (осн). Передача давления жидкостями и газами. Закон ПаскаляСкачать

Другие вопросы из категории
угловую скорость стержня после попадания пули
Видео:В сосуде под поршнем находится идеальный газ. В стенке сосуда есть клапан, с помощью - №23785Скачать

Читайте также
объеме так, что давление газа падает в n раз. Затем газ нагревают при постоянном
давлении до первоначальной температуры T. Найдите совершенную газом работу, если
его молярная масса M
Читайте также: Какими типами предохранительных клапанов необходимо оборудовать шроторазгрузитель
объемом 6 л так, что давление газа изменилось в n = 3 раза. Насколько
уменьшился объем газа в этом процессе? Ответ выразите в литрах.
постоянна. какое было первоначальное давление газа?
давление в)объем и масса Г)состояния газа данной массы.как изменится давление газа данной массы при низменной температуре если объем уменьшится в 4 раза?а)уменьшится Б)увеличится в 4 раза в)неизменнна г)для ответа недостаточно данных
изохорического нагревания увеличилось на 150 кПа. Во сколько раз возросла
температура газа, если начальное давление 50 кПа?
Видео:Давление газа | Физика 7 класс #27 | ИнфоурокСкачать

Газ нагревают в сосуде снабженном клапаном
Идеальный газ, находящийся в закрытом сосуде, оказывает давление на его стенки. Это объясняется тем что
1) молекулы прилипают к стенкам сосуда
2) идеальный газ имеет большую плотность
3) молекулы газа передают стенкам энергию
4) молекулы газа передают стенкам импульс
Молекулы идеального газа непрерывно ударяются о стенки сосуда, передавая им импульс. По второму закону Ньютона, переданный стенкам сосуда импульс определяет силу воздействия газа на стенки, то есть давление.
так стенки же как были неподвижны, так и остаются, значит они не получили импульс, а получили энергию
Стенки рассматривается как бесконечно тяжелое тело (она получает импульс, но не двигаются). Если, например, одну стенку сосуда заменить на подвижный массивный поршень, то газ начнет своим давлением разгонять поршень, передавая ему импульс.
Если более подробно. В МКТ считается, что молекулы абсолютно упруго ударяются о стенки сосуда. При ударе скорость молекулы изменяет направление, но не изменяет величины, а значит, изменяется импульс молекулы, но не ее кинетическая энергия. «Молекулы+сосуд» образуют замкнутую систему, для них выполняется законы сохранения импульса и энергии. Энергия молекул не изменяется при ударах о стенки, поэтому они не передают им энергии, а вот их импульс изменяется, значит импульс они передают.
В сосуде объёмом 2 л находится 20 г идеального газа при давлении 2 атм и температуре 300 К. Во втором сосуде объёмом 3 л находится 30 г того же газа при температуре 450 К. Чему равно давление газа (в атм) во втором сосуде?
Состояние идеального газа описывается уравнением Клапейрона — Менделеева: Молярная масса газа равна Тогда давление того же газа в другом сосуде:
В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление газа p = 4 · 10 5 Па. Расстояние от дна сосуда до поршня равно L. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газ получил количество теплоты Q = 1,65 кДж, а поршень сдвинулся на расстояние x = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтр = 3 · 10 3 Н. Найдите L. Считать, что сосуд находится в вакууме.
1) Поршень будет медленно двигаться, если сила давления газа на поршень и сила трения со стороны стенок сосуда уравновесят друг друга: p2S = Fтр, откуда
2) Поэтому при нагревании газа поршень будет неподвижен, пока давление газа не достигнет значения р2. В этом процессе газ получает количество теплоты Q12. Затем поршень будет сдвигаться, увеличивая объём газа, при постоянном давлении. В этом процессе газ получает количество теплоты Q23.
3) В процессе нагревания, в соответствии с первым началом термодинамики, газ получит количество теплоты:
4) Внутренняя энергия одноатомного идеального газа:
5) Из пп. 3, 4 получаем
в конечной формуле в числителе перед произведением силы трения и величины смещения множитель должен быть 3/2 а не 5/2
Формула верная. 5/2=1+3/2 — сумма коэффициентов перед членами с Fтр в формулах для Q и U3
А почему не учитывается атмосферное давление?
По условию сосуд находится в вакууме.
В сосуде объёмом 1 л находится 10 г идеального газа при давлении 1 атм и температуре 300 К. Во втором сосуде объёмом 3 л находится 30 г того же газа при давлении 2 атм. Чему равна температура (в К) газа во втором сосуде?
Состояние идеального газа описывается уравнением Клапейрона — Менделеева: Молярная масса газа равна Тогда температура того же газа в другом сосуде:
В сосуде неизменного объема находится идеальный газ. Если часть газа выпустить из сосуда при постоянной температуре, то как изменятся величины: давление газа, его плотность и количество вещества в сосуде?
Для каждой величины определите соответствующий характер ее изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Давление газа | Плотность газа | Количество вещества |
Поскольку из сосуда выпускают часть газа, количество вещества в сосуде уменьшается. При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа: Макроскопические параметры газа не независимы, они связаны уравнением Клапейрона — Менделеева: Согласно условию, температура содержимого газа не изменяется, объем сосуда также постоянен, следовательно, давление в сосуде после выпускания части газа уменьшается.
Немного не поняла с доказательством изменения давления газа.
Я исходила из объединенного газового закона, где при постоянных объеме и температуре, выходит, что давление тоже неизменно.. Помогите разрешить этот казус)
Не очень понимаю, что Вы называете объединенным газовым законом. Если , то ответ на Ваш вопрос очень прост. Этот закон попросту нельзя здесь использовать, как и любой другой газовый закон (Бойля-Мариотта, Гей-Люссака, Шарля), поскольку они верны только для постоянного количества вещества,а у нас количество вещества изменяется.
Закон , на самом деле, ведь просто следствие уравнения Клапейрона-Менделеева в случае, если . Действительно, . Таким образом, данный закон неформально можно называть законом «изоколичества вещества». А закон Шарля — это «изобрано/изоколичественный» закон.
В сосуде неизменного объема находится идеальный газ. Часть газа выпускали из сосуда так, что давление оставалось неизменным. Как изменились при этом температура газа, оставшегося в сосуде, его плотность и количество вещества?
Читайте также: Как сшить карманы в рамку с клапаном
Для каждой величины определите соответствующий характер ее изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Температура газа | Плотность газа | Количество вещества |
Поскольку из сосуда выпускают часть газа, количество вещества в сосуде уменьшается. При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа: Макроскопические параметры газа не независимы, они связаны уравнением Клапейрона — Менделеева: Согласно условию, давление содержимого газа не изменяется, объем сосуда также постоянен, следовательно, температура в сосуде после выпускания части газа увеличится.
Объясните пожалйуста,почему температура увеличивается,ведь давление остается постоянным
Газа стало меньше, уменьшилось
Если температура будет увеличиваться, тогда получится, что правая часть(URT) уравнения Клапейрона-Менделлева больше левой(PV), а они должны быть равны.
Как v может уменьшатся, если он const?
По условию: «Часть газа выпускали из сосуда».
(При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа: p=m\V)
Почему объем прежний, если он тоже уменьшился?
По условию: «В сосуде неизменного объема находится идеальный газ».
В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. На дне сосуда лежит стальной шарик (см. рисунок). Из сосуда выпускается половина газа при неизменной температуре. Как изменится в результате этого объём газа, его давление и действующая на шарик архимедова сила?
Для каждой величины определите соответствующий характер изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Обьем газа | Давление газа | Архимедова сила |
В процессе выпускания газа поршень будет перемещаться, но в начальном и конечном состояниях (до и после выпускания газа) поршень покоится, а значит, полная сила, действующая на него, равна нулю. Отсюда делаем вывод, что давление не изменяется, т. к.
Считая газ идеальным, применяем к нему закон Менделеева — Клапейрона: Поскольку давление не изменилось, температура постоянна, а масса газа уменьшилось вдвое, объём газа также уменьшился вдвое.
Сила Архимеда определяется плотностью среды, в которую помещено тело Т. к. число частиц в сосуде уменьшилось вдвое и объём уменьшился вдвое, концентрация, а значит, и плотность газа не изменились. Таким образом, сила Архимеда, действующая на шар, не изменилась.
Но т.к. V газа уменьшился, Fарх тоже должна уменьшиться? И по поводу давления газа: PV/T(закон), T=const, V уменьшается, следовательно P увеличивается, объясните пж., в чём я ошибся?
В формуле для силы Архимеда стоит объём тела (шара), а не газа.
Закон PV/T=const выполняется при постоянном количестве газа, а в этой задаче количество газа изменяется.
В цилиндрическом сосуде под массивным поршнем находится газ. Поршень не закреплён и может перемещаться в сосуде без трения (см. рисунок). В сосуд закачивается ещё такое же количество газа при неизменной температуре. Как изменятся в результате этого давление газа и концентрация его молекул?
Для каждой величины определите соответствующий характер изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Поскольку поршень не закреплён, то давление газа равно сумме атмосферного давления и давления поршня, а значит, оно не зависит от количества вещества газа. Давление газа не изменится.
По условию температура неизменна, значит, из уравнения состояния идеального газа заключаем, что концентрация молекул газа тоже не изменится.
Объём 3 моль водорода в сосуде при температуре 300 К и давлении равен Во сколько раз отличается от него объём 3 моль кислорода при той же температуре и том же давлении?
Водород и кислород в сосуде можно считать идеальными газами. Идеальный газ подчиняется уравнению состояния Клапейрона — Менделеева: Поскольку и водорода, и кислорода используется по 3 моль, при той же температуре и том же давлении кислород будет занимать такой же объем
Идеальный газ, находящийся в сосуде, переводят из состояния 1 в состояние 2. В таблице указаны значения давления р, объёма V и температуры Т газа в этих состояниях.
1) из сосуда имеется утечка газа
3) сосуд плотно закрыт и в нём находится 0,8 10 -3 молей газа
4) сосуд плотно закрыт и в нём находится 0,08 молей газа
Идеальный газ подчиняется уравнению Клапейрона-Менделеева: Подсчитаем, какое количество вещества соответствует состояниям 1 и 2. В первом случае имеем:
Таким образом, в обоих состояниях количество газа совпадает. А значит, можно сделать вывод, что сосуд плотно закрыт и в нём находится 0,08 молей газа.
Поршень может свободно без трения перемещаться вдоль стенок горизонтального цилиндрического сосуда. В объёме, ограниченном дном сосуда и поршнем, находится воздух (см. рисунок). Площадь поперечного сечения сосуда равна 25 см 2 , расстояние от дна сосуда до поршня равно 20 см, атмосферное давление 100 кПа, давление воздуха в сосуде равно атмосферному. Поршень медленно перемещают на 5 см вправо, при этом температура воздуха не меняется. Какую силу требуется приложить, чтобы удержать поршень в таком положении? Ответ приведите в ньютонах.
Воздух в сосуде можно считать идеальным газом. Процесс расширения газа идет изотермически, а значит, согласно закону Бойля — Мариотта, Отсюда находим давление газа под поршнем в новом положении:
Определим теперь силу, которую необходимо приложить к поршню. Для этого рассмотрим второй закон Ньютона для поршня в проекции на горизонтальную ось: Таким образом, необходимо приложить силу
В пяти пронумерованных сосудах объёмом 5 л каждый находятся идеальные газы при одинаковом давлении 200 кПа. В таблице для каждого сосуда указаны газ и его масса.
| Номер сосуда | Газ | Масса газа, г |
| 1 | азот | 14 |
| 2 | кислород | 8 |
| 3 | азот | 11,2 |
| 4 | кислород | 9,6 |
| 5 | азот | 5,6 |
В сосудах находятся термометры, позволяющие измерять температуру в пределах от –50 °С до + 50 °С. В каких сосудах по показаниям этих термометров можно будет определить температуру газа? В ответе запишите номера сосудов слитно без пробела.
Определим температуру газа в каждом из сосудов. Из уравнения Менделеева — Клапейрона:
Для первого сосуда: или −33 °C.
Для второго сосуда: или 208 °C.
Для третьего сосуда: или 28 °C.
Для четвёртого сосуда: или 128 °C.
Для пятого сосуда: или 329 °C.
Таким образом, температуру можно будет измерить в первом и третьем сосудах.
В пяти пронумерованных сосудах объёмом 5 л каждый находятся идеальные газы при одинаковом давлении 200 кПа. В таблице для каждого сосуда указаны газ и его масса.
| Номер сосуда | Газ | Масса газа, г |
| 1 | азот | 14 |
| 2 | кислород | 8 |
| 3 | азот | 11,2 |
| 4 | кислород | 9,6 |
| 5 | азот | 5,6 |
В сосудах находятся термометры, позволяющие измерять температуру в пределах от +100 °С до +250 °С. В каких сосудах по показаниям этих термометров можно будет определить температуру газа? В ответе запишите номера сосудов слитно без пробела.
Определим температуру газа в каждом из сосудов. Из закона Менделеева — Клапейрона:
Для первого сосуда:
Для второго сосуда:
Для третьего сосуда:
Для четвёртого сосуда:
Для пятого сосуда:
Таким образом, температуру можно будет измерить во втором и четвёртом сосудах.
Аналоги к заданию № 11678: 11862 Все
Школьник проводил эксперименты по изучению законов идеального газа. Он взял сосуд, имеющий постоянный объём 2 л и снабжённый термометром и манометром. Медленно нагревая воздух в сосуде и записывая показания приборов, он получил зависимость давления р газа от его температуры Т. Полученную зависимость школьник оформил в виде точек, нанесённых на pT-диаграмму (см. рисунок). Пользуясь этой диаграммой, найдите, сколько примерно молей воздуха содержалось в сосуде. Ответ дайте с точностью до сотых.
Идеальный газ подчиняется уравнению состояния Клапейрона — Менделеева: Откуда количество вещества равно Таким образом, для ответа на вопрос задачи необходимо определить значение отношения Проще всего это сделать, аппроксимирую результаты школьника на графике линейной зависимостью и вычисляя угловой коэффициент наклона получившейся прямой (см. рис.).
В результате для количества вещества в сосуд имеем
В сосуде объёмом 3 л при температуре +70 °C находится смесь воздуха с водяными парами. Давление в сосуде равно 99,2 кПа, относительная влажность воздуха 50%. Давление насыщенного водяного пара при данной температуре равно 31,1 кПа. Какое количество воздуха находится в сосуде? Ответ выразите в миллимолях и округлите до целого числа.
По закону Дальтона давление в сосуде равно где и — парциальные давления воздуха и водяного пара соответственно. Относительная влажность воздуха связана с парциальным давлением пара при некоторой температуре и давлением насыщенных паров при той же температуре соотношением Состояние идеального газа описывается уравнением Клапейрона — Менделеева: Объединив все уравнения, найдем количество воздуха в сосуде:
В сосуде объёмом 1,5 л при температуре +50 °C находится смесь воздуха с водяными парами. Давление в сосуде равно 99,4 кПа, относительная влажность воздуха 50%. Давление насыщенного водяного пара при данной температуре равно 12,5 кПа. Какое количество воздуха находится в сосуде? Ответ выразите в миллимолях и округлите до целого числа.
По закону Дальтона: где — давление в сосуде, и — давление воздуха и водяного пара соответственно. Относительная влажность воздуха связана с парциальным давлением пара при некоторой температуре и давлением насыщенных паров при той же температуре соотношением Состояние идеального газа описывается уравнением Клапейрона — Менделеева: Объединив все уравнения, найдём количество воздуха в сосуде:
Почему вычтено парциальное давление водяного пара? Разве водяной пар не является частью воздуха и его количество не входит в количество воздуха? Думаю, вопрос задачи стоит переформулировать: «Какое количество сухого воздуха. «
В условии говорится о «смеси воздуха с водяными парами», поэтому в данной задаче под словом «воздух» следует понимать воздух без водяных паров.
В сосуде, закрытом поршнем, находится идеальный газ. На рисунке показан график зависимости объема газа от температуры.
В каком состоянии давление газа наибольшее?
Идеальный газ подчиняется уравнению Клапейрона — Менделеева: Следовательно, давление газа максимально, когда максимальна величина Из графика видно, что эта величина максимальна в точке С.
В закрытом сосуде находятся водяной пар и некоторое количество воды. Как изменятся при изотермическом уменьшении объема сосуда следующие три величины: давление в сосуде, масса воды, масса пара?
Для каждой величины определите соответствующий характер изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Давление в сосуде | Масса воды | Масса пара |
Пояснение. Ключом к пониманию этого задания является определение понятия насыщенного водяного пара. По определению это такой пар, который находится в динамическом равновесии с жидкостью. При изотермическом уменьшении объема сосуда с водяным паром динамическое равновесие сохранится, но при этом часть водяного пара сконденсируется.
В закрытом сосуде над поверхностью жидкости находится насыщенный водяной пар, то есть пар, который находится в динамическом равновесии с жидкостью. Процесс испарения с поверхности жидкости уравновешен обратным процессом конденсации пара. Концентрация насыщенного водяного пара определяется только температурой. При изотермическом процессе динамическое равновесие сохранится. Так как температура не изменяется, концентрация пара будет оставаться постоянной. Поскольку объем уменьшается, часть пара сконденсируется. Следовательно, в результате уменьшения объема сосуда масса пара уменьшится, а масса воды увеличится. Насыщенный пар можно считать идеальным газом, а значит для него выполняется уравнение состояния Поскольку ни температура, ни концентрация не изменяются, не будет изменяться и давление в сосуде.
🌟 Видео
Давление газаСкачать

Связь между давлением, объёмом и температурой газаСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Идеальный газ. Уравнение Менделеева-Клапейрона.Скачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Урок 45 (осн). Давление газаСкачать

Урок 47 (осн). Расчет давления жидкости на дно и стенки сосудаСкачать

В горизонтальном цилиндрическом сосуде - Задача ЕГЭ по физике Часть 2Скачать

Давление газа на стенку.Скачать

Физика 7 класс (Урок№19 - Природа давления газов и жидкостей. Закон Паскаля.)Скачать

Физика # 10. Механика жидкости и газаСкачать

Расчёт давления жидкости на дно и стенки сосуда | Физика 7 класс #30 | ИнфоурокСкачать

Урок 195. Изотермы реального газаСкачать

Давление газа и жидкостей. Решение задачСкачать

Задание 10 ЕГЭ ПрофильСкачать


