Хотя митральный клапан отделяет левое предсердие от левого желудочка, анатомически он находится не между этими двумя камерами сердца, а полностью расположен в левом желудочке. Беспрепятственное наполнение и опорожнение левого желудочка обеспечиваются особым строением митрального клапанного аппарата, знание особенностей которого необходимо для понимания природы различных заболеваний митрального клапана и проведения ЭхоКГ.
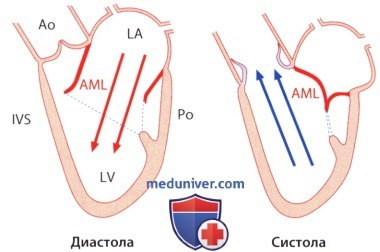
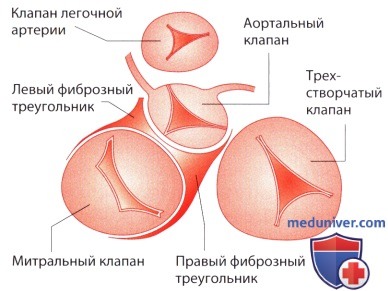
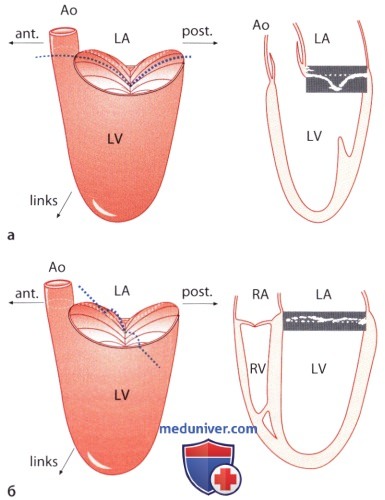
В отличие от правого желудочка, в котором трехстворчатый клапан и конус легочной артерии пространственно отделены друг от друга, отверстия митрального и аортального клапанов представляют собой как бы единое целое, которое ограничивает базальный отдел левого желудочка. Оба компонента аортомитрального канала образуют между собой угол, равный 100-110°, и отделены лишь передней створкой митрального клапана. В силу указанных анатомических особенностей весь левый отдел сердца при открытом атриовентрикулярном (митральном) отверстии превращается во вносящий тракт, а при закрытом — в выносящий тракт левого желудочка; передняя створка митрального клапана выполняет роль реле, регулирующего направление кровотока. Бесперебойная работа этого механизма является структурной и функциональной предпосылкой целостности отдельных компонентов митрального клапанного аппарата.
а) Митральное кольцо. Дорсальнее аортального клапана находятся правый и левый фиброзный треугольники. Они служат опорными площадками, к которым фиксируют кольцо клапанного протеза типа Карпантье-Эдвардса. Между этими треугольниками тянется фиброзная аортомитральная перегородка, к которой прикрепляется передняя створка митрального клапана. От этой соединительнотканной структуры в латеральном направлении тянутся коллагеновые тяжи, которые в виде фиброзного хомута охватывают митральное отверстие, при этом задняя часть отверстия остается полностью свободной. Так митральное кольцо образует границу между миокардом желудочка и предсердия.
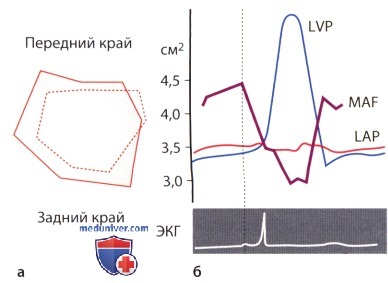
1. Изменения, претерпеваемые митральным клапаном во время сердечного цикла. Из-за столь асимметричного строения митрального кольца с его малоподвижной фиброзной передней частью окружности и сокращающейся задней полуокружностью изменение его размеров во время сердечного цикла сопровождается изменением его формы. Максимальных размеров митральное кольцо в течение сердечного цикла достигает в поздней диастоле непосредственно перед сокращением предсердия. При сокращении предсердия площадь поверхности клапанного кольца уменьшается на 15-20%. Этим облегчается герметизация митрального отверстия в систолу желудочка, при которой площадь поверхности митрального кольца уменьшается еще на 10-15%. Начиная с середины систолы и до ее завершения, митральное кольцо вновь расширяется, и это расширение продолжается в диастолу.
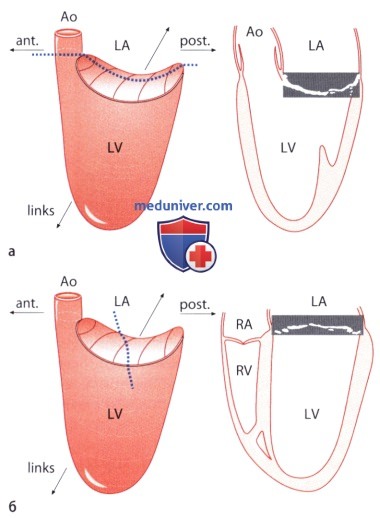
2. Положение митрального кольца. Поскольку плоскость митрального кольца служит ориентиром, относительно которого оценивают степень пролапса митрального клапана, то визуализация пространственной конфигурации митрального кольца имеет важное клиническое значение: оно имеет седловидную форму, т.е. форму геометрического тела, которое имеет взаимно противоположное направление кривизны поверхностей в длину и в профиль. Наиболее высокие точки седла лежат в передней (аортальной) и задней части, а между этими точками расположена вогнутая в сторону левого предсердия седловидная плоскость; наиболее низкие точки расположены медиально (септально) и латерально, и между этими крайними точками находится выпуклая часть седловидной поверхности.
При ЭхоКГ в позиции четырехкамерного сердца изображение включает левый желудочек, межжелудочковую перегородку, латеральную стенку желудочка, причем всегда, даже при нормальном митральном клапане, можно видеть также седловидную выпуклость его плоскости, «выпячивающуюся» в левое предсердие. Поэтому пролапс митрального клапана наиболее четко можно визуализировать лишь в плоскости, ориентированной вдоль длинной оси левого желудочка, которая в норме соответствует вогнутости седла.
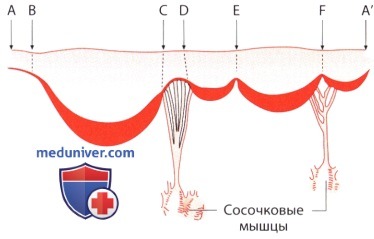
б) Створки митрального клапана. Створки митрального клапана прикрепляются вдоль всей окружности митрального кольца. На свободном крае створок имеется несколько складок, из которых две — переднелатеральная и заднемедиальная — как правило, постоянные и представляют собой комиссуры; они являются ориентирами для выделения передней и задней створок клапана. Передняя створка митрального клапана имеет длину 2-3 см и по форме вариабельна — от треугольной до полукруглой.
Задняя створка митрального клапана почти вдвое длиннее передней, прикрепляется на более значительном протяжении митрального кольца и делится двумя складками на три сегмента, из которых центральный является доминирующим (переднелатеральный сегмент — Р1, центральный сегмент — Р2, заднемедиальный сегмент — Р3). Базальные две трети передней створки тонкие, имеют гладкую поверхность и при трансиллюминации просвечивают; на створке имеется полулунная линия, которая напоминает шов и отделяет эту часть створки от свободного ее края. Последний более плотный, шероховатый и не просвечивает (эта часть створки клапана соответствует плоскости вплетения сухожильных хорд). На задней створке митрального клапана имеется корреспондирующая шероховатая зона, несколько меньшая, чем на передней. Во время закрытия митрального клапана шероховатые зоны смыкаются, причем граница смыкания створок проходит вдоль полулунной линии. Для эффективного закрытия митрального клапана необходимо, чтобы дистальные концы его створок не только соприкасались, но и смыкались на довольно значительном протяжении.
в) Сосочковые мышцы и сухожильные хорды. Фиксация митрального клапанного аппарата в левом желудочке обеспечивается сосочковыми мышцами и сухожильными хордами. В отличие от переднелатеральной сосочковой мышцы, заднемедиальная сосочковая мышца обычно бывает расщеплена, и половинки ее имеют выпуклую или вогнутую форму, так что при сокращении пространство, которое их разделяет, исчезает, и они действуют как единое целое. Каждая из сосочковых мышц имеет на конце своем примерно шесть заостренных головок, при этом от каждой из головок от ходят по две сухожильные хорды первого порядка, каждая из которых веерообразно переходит примерно в пять терминальных сухожильных хорд. Поэтому при разрыве одной головки отходит 10 (всего до 120) терминальных сухожильных хорд. Все они прикрепляются к одной створке митрального клапана, поэтому при пролапсе речь идет о выбухании одной створки.
В противоположность этому сосочковая мышца с помощью своих сухожильных хорд прикрепляется к обеим створкам митрального клапана, поэтому при разрыве или дисфункции сосочковой мышцы обычно страдают обе створки митрального клапана.
Читайте также: Клапан для разряжения воздуха в канализации
1. Кровоснабжение. Обе сосочковые мышцы имеют двойное кровоснабжение: переднелатеральная мышца питается от второй септальной ветви передней межмышечной артерии, а также от ветвей огибающей артерии, заднелатеральная сосочковая мышца кровоснабжается от септальной ветви задней межмышечной артерии (источником которой в основном является правая коронарная артерия), а также от ветвей огибающей артерии. Хотя перфузия сосочковых мышц в основном осуществляется интрамуральными ветвями коронарных артерий, периферическая субэндокардиальная область этих мышц питается также еще и посредством диффузии кислорода из полости желудочка. Поскольку источников питания у сосочковых мышц несколько, ишемия или инфаркт всех сосочковых мышц наблюдается редко, задняя сосочковая мышца из-за большей вариабельности источников питания в большей степени подвержена опасности разрыва, чем передняя.
2. Положение сосочковых мышц. Анатомическое название переднелатеральной и заднемедиальной сосочковой мышцы дано на основании их расположения относительно стенки левого желудочка, а не оси сердца или вносящего или выносящего тракта. С анатомо-физиологической точки зрения передняя створка митрального клапана делит полость левого желудочка на расположенный кпереди выносящий тракт (чье дно она составляет) и на расположенный кзади вносящий тракт («крышей» которого она является).
«Крыша» выносящего тракта образована передней частью межжелудочковой перегородки, а не «передней» стенкой левого желудочка, которая является ее левой границей. Смыкающиеся створки митрального клапана и сосочковые мышцы, головки которых направлены на комиссуры, расположены в одной плоскости, т.е. сосочковые мышцы направлены медиолатерально («задняя» створка митрального клапана расположена медиально, «передняя» — латерально). Обе сосочковые мышцы расположены в задней половине левого желудочка. Их сокращение вызывает растяжение створок митрального клапана кзади, что препятствует обструкции выносящего тракта левого желудочка в систолу. Сокращение сосочковых мышц способствует также тому, что расстояние между головками сосочковых мышц и плоскостью митрального клапана во время систолы сохраняется относительно постоянным, несмотря на систолическое опущение плоскости клапана и движение нижней стенки левого желудочка кнутри.
3. Поведение во время сердечного цикла. Сосочковые мышцы во время сердечного цикла «ведут себя» примерно так же, как миокард свободной стенки. Поскольку они не полностью интегрированы в стенку, а связаны с помощью сухожильных хорд с митральным клапаном, то во время сердечного цикла на них действуют и другие силы. В связи с этим характер их растяжения кпереди и сокращение в соответствии с законом Франка-Старлинга отличаются: в то время как миокард свободной стенки быстро растягивается в результате наполнения желудочка, длина сосочковых мышц в диастолу увеличивается незначительно. Лишь с началом изоволюмического сокращения желудочка, когда происходит закрытие митрального клапана, сосочковые мышцы, прикрепляющиеся к нему, резко растягиваются вперед. Степень такого растяжения сосочковых мышц определяет силу их сокращения. Пассивное смещение сосочковых мышц к началу систолы дает возможность сближения створок митрального клапана друг с другом и с митральным кольцом.
Редактор: Искандер Милевски. Дата публикации: 3.1.2020
Видео:ЭхоКГ. Створки и сегменты митрального клапанаСкачать

Глубина коаптации створок митрального клапана
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Северо-Западный федеральный медицинский исследовательский центр» Минздрава РФ (дир. — акад. РАН Е.В. Шляхто), Санкт-Петербург, Россия
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
Опыт коррекции митральной недостаточности различной этиологии с использованием безимплантационной методики
Журнал: Кардиология и сердечно-сосудистая хирургия. 2016;9(6): 21-37
Гордеев М. Л., Майстренко А. Д., Ярков И. В., Сухова И. В., Гурщенков А. В. Опыт коррекции митральной недостаточности различной этиологии с использованием безимплантационной методики. Кардиология и сердечно-сосудистая хирургия. 2016;9(6):21-37.
Gordeev M L, Maystrenko A D, Iarkov I V, Sukhova I V, Gurshchenkov A V. . Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2016;9(6):21-37.
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
Цель исследования — оценить эффективность коррекции митральной недостаточности (МН) различной этиологии с использованием метода шовной пластики фиброзного кольца (ФК). Материал и методы. В исследование были включены 389 пациентов с МН различной этиологии, которым выполнена шовная аннулопластика (АП) митрального клапана (МК) в условиях искусственного кровообращения (ИК) и кровяной изотермической кардиоплегии. У 180 пациентов причиной митральной регургитации (МР) была ишемическая болезнь сердца (ИБС), у 209 — МН имела «неишемическую» этиологию. У всех пациентов основным компонентом патогенеза МР была выраженная дилатация ФК. Результаты. Шовная АП позволила значительно редуцировать диаметр ФК как у пациентов с ишемической, так и неишемической МР. В отдаленном периоде ни в одной из групп диаметр ФК достоверно не увеличился, что позволяет говорить об эффективности пластики и стабильности результата. Свобода от рецидива МР у больных с исходно выраженной ишемической МН составила 77,5% в течение 5-летнего срока наблюдения. Свобода от рецидива МН у больных в группе «неишемической» МН в течение 8 лет, рассчитанная по методу Каплана—Мейера, составила 93%. Причинами рецидива МН в данной группе больных являлось прогрессирование основного заболевания. Выводы. Шовная АП является эффективным и надежным методом коррекции МН различной этиологии, при выраженной дилатации ФК. При этом не наблюдается значимого ускорения кровотока на МК. Причинами рецидива МР в отдаленном периоде являются экстрааннулярные факторы.
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Северо-Западный федеральный медицинский исследовательский центр» Минздрава РФ (дир. — акад. РАН Е.В. Шляхто), Санкт-Петербург, Россия
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
ФГБУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова», Санкт-Петербург
Примечание. АКШ — аортокоронарное шунтирование; ЧКА — чрескожная коронарная ангиопластика, ОКС — острый коронарный синдром.
Приобретенные пороки митрального клапана (МК), сопровождающиеся возникновением митральной регургитации (МР), занимают по частоте второе место в общей структуре клапанных пороков сердца. Заболеваемость в развитых странах составляет 5 случаев на 10 000 населения [6, 13]. Митральная недостаточность (МН) условно делится на первичную и вторичную по этиопатогенетическому принципу. Основными причинами возникновения первичной МН являются синдром дисплазии соединительной ткани с пролапсом створок, ревматизм и инфекционный эндокардит (ИЭК) [6, 11, 13, 15]. Механизм возникновения некомпетентности МК в данной группе чаще всего обусловлен конкретной причиной (отрыв хорд, пролапс створок, перфорация створки), которая часто сопровождается расширением фиброзного кольца (ФК) МК [6]. Среди причин вторичной МН (функциональной) преобладают ишемическая МР и относительная МН, осложняющая течение других пороков сердца. В данной группе генез МР чаще всего обусловлен дилатацией ФК или относительным ограничением подвижности одной из створок вследствие дилатации и нарушения сократимости левого желудочка (ЛЖ) [3, 5, 7, 8].
В настоящее время предпочтение при оперативном лечении данной патологии отдается клапансохраняющим операциям [4]. Основная роль при выполнении реконструктивного вмешательства на МК отводится аннулопластике (АП) как «фундаменту», на котором будут выполняться другие компоненты пластики (резекция створок, протезирование хорд и т. д.) [6, 8]. В большинстве клиник уменьшение диаметра ФК МК достигается имплантацией опорных колец (ОК). Однако многие авторы [3, 8, 10, 15, 17] отмечают рецидив МН в течение первых 3 лет после операции у 15—30% больных. В настоящее время предложено несколько видов ОК, различающихся по своей структуре, геометрической форме, материалу, что также указывает на отсутствие удовлетворенности от результатов и необходимость поиска путей снижения вероятности рецидива МР. С другой стороны, предложен ряд методик безимплантационной редукции размера ФК М.К. Однако результаты их использования представлены единичными клиниками [7, 11, 13, 15]. Многие хирурги с недоверием относятся к состоятельности шва ФК. В связи с этим проведенное нами исследование непосредственных и отдаленных результатов коррекции МН различной этиологии методом шовной АП представляется весьма актуальным.
Читайте также: Как ведет себя машина если зажаты клапана
Цель исследования — доказать эффективность и стабильность результатов митральной пластики, сопровождающейся редукцией размеров ФК безимплантационным (шовным) методом.
Для достижения указанной цели мы предприняли анализ непосредственных и отдаленных результатов шовной АП при МН различного генеза. При этом оценены степень редукции ФК и связанные с ней изменения функции МК, динамика размеров полостей сердца и проявлений сердечной недостаточности (СН). Эффективность оперативного вмешательства оценивалась также по критерию выживаемости.
Видео:Болезни митрального клапана. Пролапс митрального клапана, стеноз, регургитация.Скачать

Материал и методы
В Северо-Западном федеральном медицинском исследовательском центре им. В.А. Алмазова операции коррекции МН различной этиологии с использованием шовной АП выполняются с 2005 г. В исследование включены 389 больных (180 — с МР ишемической этиологии и 209 — с МН «неишемического» генеза). Критерии включения: исходное расширение ФК (более 32 мм) и возможность наблюдения за пациентами в отдаленном периоде.
Средний срок наблюдения после операции составил 82,3±8,7 мес. Для объективизации данных все эхокардиографические (ЭхоКГ) исследования до и после вмешательства выполнялись одним специалистом на аппарате Vivid 9 («General Electric Corp.», США). Группы анализировались отдельно.
Дизайн исследования. Все пациенты с ишемической природой МН были разделены на три группы. В 1-ю группу (n=80) включены пациенты с выраженной МН (III—IV степень), которым выполняли комбинированное вмешательство — реваскуляризацию миокарда и шовную АП М.К. Во 2-ю группу (n=50) включены пациенты с МН II степени, также перенесшие комбинированное вмешательство. В 3-ю группу (n=50) выделены пациенты с ишемической МР II cтепени, которым коррекция порока МК не выполнялась и оперативное вмешательство ограничивалось реваскуляризацией миокарда. Окончательное решение о необходимости коррекции умеренной МН принимал оперирующий хирург.
Пациенты из группы МН «неишемического» генеза, включенные в исследование, имели значимую (II и выше) степень МН, этиологической причиной которой являлись диспластические изменения клапана — 43,4% (n=90), относительная МН при пороках аортального клапана — 42,6% (n=89), хроническая ревматическая болезнь сердца (ХРБС) — 14% (n=30).
Первичной конечной точкой исследования для всех пациентов считали летальный исход, обусловленный любыми причинами на любых сроках после операции. Вторичной точкой являлся рецидив МН, потребовавший реоперации на МК.
Методика и технология выполненных операций. Стандартный доступ к МК осуществлялся разрезом стенки левого предсердия (ЛП) длиной около 5—7 см параллельно межпредсердной борозде или транссептальный доступ через овальную ямку межпредсердной перегородки длиной 4—6 см. Шовную А.П. МК выполняли по методике, описанной R. Batista [12] в 2001 г. и модифицированной в нашей клинике. Первым этапом визуализировали зоны комиссур М.К. Начинали от наружной комиссуры П-образным швом на тефлоновой прокладке нитью Premicron 2−0. После его завязывания одной нитью выполнялся стежок через ФК вдоль задней створки, другой нитью параллельный стежок через ткань ЛП, при этом расстояние между нитями одного стежка должно быть не менее 2—4 мм. После каждого стежка нити связывали между собой, создавая складку. Таким образом, формировали от 8 до 10 стежков с шагом 7—10 мм вдоль всей задней полуокружности ФК до внутренней комиссуры, где обе нити связывали и фиксировали швом на тефлоновой прокладке. Степень редукции диаметра ФК контролировали сайзером, эффективность пластики МК — «водяной пробой» и чреспищеводной эхокардиографией (ЧПЭхоКГ). Данный вид АП позволяет гофрировать заднюю полуокружность ФК МК и способствует «надвиганию» задней створки на переднюю, тем самым восстанавливая их коаптацию.
Статистическая обработка результатов. Полученные данные обрабатывали с применением программного продукта Statistica 10.0 («StatSoft, Inc.»). Достоверность различий средних двух выборок оценивали с использованием методов описательной статистики для выборок с нормальным распределением (t-критерий Стьюдента). Выживаемость пациентов в течение периода наблюдения оценивали по методу Каплана—Мейера.
Видео:ЭхоКГ в оценке функции протезированных клапанов сердца и диагностике осложнений протезированияСкачать

Результаты
Результаты хирургического лечения больных с ишемической МР. В табл. 1 представлено описание течения ишемической болезни сердца (ИБС) у исследуемых пациентов. У большинства анамнез ИБС был более 3 лет. При этом у 1/3 пациентов в каждой группе имел место перенесенный ранее инфаркт миокарда (ИМ) нижней стенки ЛЖ.
Таблица 1. Особенности течения ИБС у пациентов с ишемической митральной регургитацией
Наиболее частым осложнением раннего послеоперационного периода являлась острая сердечно-сосудистая недостаточность (ССН), что требовало инфузии инотропных и вазопрессорных препаратов. В 4 случаях для стабилизации гемодинамики потребовались механические методы поддержки (ВАБКП). Чаще данное осложнение встречалось у больных в группе с МН III—IV степени. Это связано с более тяжелым течением порока МК и исходно сниженной у большинства пациентов фракцией выброса (ФВ) Л.Ж. Летальных исходов в раннем послеоперационном периоде не было. Другие осложнения этого периода, встречавшиеся у исследуемых больных, приведены в табл. 2.
Таблица 2. Осложнения раннего послеоперационного периода Примечание. ССС — сердечно-сосудистая система; ФП — фибрилляция предсердий; ПЭКС — постоянный электрокардиостимулятор; ИВЛ — искусственная вентиляция легких; ОНМК — острое нарушение мозгового кровообращения.
В табл. 3 представлены результаты коррекции выраженной МН ишемического генеза по данным ЭхоКГ. В ранние сроки после вмешательства наблюдалось достоверное уменьшение размеров и объемов ЛЖ в связи с ликвидацией МР. В отдаленном периоде также наблюдалось изменение размеров полости ЛЖ с увеличением его сократительной способности, вследствие процессов обратного ремоделирования. Случаев формирования митрального стеноза после пластики МК не выявлено.
Таблица 3. Динамика основных параметров ЭхоКГ в 1-й группе (n=80) Примечание. КДР — конечный диастолический размер; КСР — конечный систолический размер; КДО — конечный диастолический объем; КСО — конечный систолический объем; УО — ударный объем, р — t-критерий Стьюдента; нд — недостоверно.
Результаты использования шовной АП у пациентов с тяжелой МН в отдаленном периоде оценивали по количеству случаев рецидива МР II и более степени. В 1-й группе (n=80) рецидив МН зарегистрирован у 18 (22%) пациентов, при этом МН III—IV степени выявлен у 8 (10%) больных.
Свободу от рецидива МН рассчитывали по методу Каплана—Мейера. Она составила 77,5% в течение 5-летнего срока наблюдения (рис. 1). В отдаленном периоде трем больным потребовалось повторное вмешательство по поводу рецидива М.Р. Во всех случаях выполнено протезирование МК.
Рис. 1. Свобода от рецидива МН в 1-й группе.
Группы пациентов с ишемической митральной недостаточностью II степени (2-я и 3-я) были исходно сравнимы по клинической характеристике (см. табл. 1) и данным ЭхоКГ (табл. 4).
Таблица 4. Характеристика митральной регургитации во 2-й (n=50) и 3-й (n=50) группах Примечание. EROA — effective regurgitant orifice area; р — t-критерийСтьюдента; нд — недостоверно.
Течение раннего послеоперационного периода у пациентов с умеренной МН не отличалось и не зависело от факта коррекции порока. Различия между группами с корригированной и некорригированной ишемической МР выявлены в отдаленном периоде. Рецидив М.Н. III степени зарегистрирован у 2 (3,3%) больных после коррекции, а прогрессирование МН у больных после изолированной реваскуляризации миокарда выявлено в 9 (18%) случаях.
Расчетная свобода от МН в группе после коррекции порока в течение 5-летнего срока наблюдения составила 98%, а в группе с изолированной реваскуляризацией миокарда — 82% (рис. 2).
Рис. 2. Свобода от рецидива МР в 3-й группе.
Оценку клинического статуса больных выполняли до операции и при контрольном осмотре в отдаленном периоде у выживших пациентов (табл. 5). Коррекция М.Н. позволила в значительной степени уменьшить проявления СН и стенокардии напряжения в течение всего срока наблюдения.
Таблица 5. Клиническое состояние пациентов ИБС, осложненной митральной регургитацией в отдаленном периоде Примечание. * — p
Читайте также: Клапан регулирующий для газов
В отдаленном периоде умерли 12 (6,8%) пациентов. Пятилетняя выживаемость больных с ишемической МН, рассчитанная по методу Каплана—Мейера, составила 90,8% (рис. 3). Причиной смерти 1 больного являлся разрыв аневризмы брюшного отдела аорты (БоА), в 4 случаях — острое нарушение мозгового кровообращения (ОНМК), в 7 — прогрессирование СН.
Рис. 3. Пятилетняя выживаемость пациентов с ишемической МР после операции.
Результаты хирургического лечения больных с МР «неишемического» генеза. Основным механизмом формирования значимой МР у пациентов без анамнеза ИБС являлась дилатация ФК МК (42,5±3,5 мм). Вторым по частоте являлся пролапс створок как следствие изменения площади створок, длины хорд или их отрыва (табл. 6).
Таблица 6. Причины митральной регургитации у пациентов с «неишемической» этиологией порока
В зависимости от этиологической причины отличался механизм возникновения МН в группах. В группе с мезенхимальной дисплазией (МД) у всех пациентов отмечали наличие дилатации ФК МК и гемодинамически значимого пролапса одной или двух створок клапана, в большинстве случаев обусловленного отрывом хорд либо их элонгацией. В группе с относительной МН, сформировавшейся на фоне аортального порока, основной причиной МР служило развитие процессов сферического ремоделирования, дилатации ЛЖ, сопровождаемых аннулодилатацией. Различные механизмы формирования струи регургитации определяли различную хирургическую тактику у данных пациентов (табл. 7).
Таблица 7. Методы хирургической коррекции МН «неишемической» этиологии (n=209) Примечание. АП МК — аннулопластика митрального клапана; ЗС — задняя створка митрального клапана; ПС МК — передняя створка митрального клапана; ФК — фиброзное кольцо; МД — мезенхимальная дисплазия; Отн. МН — относительная митральная недостаточность; ХРБС — хроническая ревматическая болезнь сердца.
В табл. 8 представлена динамика изменения ЭхоКГ-параметров.
Таблица 8. Динамика ЭхоКГ-критериев у пациентов с МН «неишемической» этиологии Примечание. ПЖ — правый желудочек; МЖП — межжелудочковая перегородка; ЗС — задняя стенка; КДР — конечный диастолический размер; КСР — конечный систолический размер; КДО — конечный диастолический объем; КСО — конечный систолический объем; УО — ударный объем; р — критерий Манна—Уитни, нд — недостоверно.
За период наблюдения умерли 26 (12,4%) пациентов: 9 — из группы с МД, 14 — из группы с относительной МН, 3 — с ХРБС. При анализе показателей летальности в отдаленном периоде 8-летняя выживаемость в целом у всех пациентов (n=209), рассчитанная по методу Каплана—Мейера, составила 87,6% (рис. 4). Причиной летальных исходов 12 пациентов (все больные с имплантированными механическими протезами (МП) АК) послужили эмболические осложнения вследствие нарушения режима антикоагулянтной терапии, в 1 случае причина смерти осталась неизвестной. Прогрессирование С.Н. наблюдали у 8 больных. В 2 случаях достоверно установлена тромбоэмболия легочной артерии (ТЭЛА), причиной которой послужили изменения в венозной системе нижних конечностей, в остальных случаях достоверно источник и бассейн эмболии не выявлены. В группе пациентов без имплантации МП клапанов показатели свободы от ОНМК и тромбоэмболических осложнений в течение 8 лет составили 92 и 94%, в группе пациентов с МП АК — 73 и 70% соответственно.
Рис. 4. Восьмилетняя выживаемость больных с неишемической этиологией МН после операции.
Свобода от реоперации в течение 8 лет, рассчитанная по методу Каплана—Мейера, составила 93%.
В отдаленном периоде произведен расчет показателей свободы от гемодинамически значимой (II и более степени) МН по методу Каплана—Мейера. Суммарно у всех пациентов, которым выполняли коррекцию МР с применением метода непрерывной шовной АП, данный показатель в течение 8 лет составил 85,6% (рис. 5). При групповом анализе хуже результаты были у пациентов с МД — 87% и ХРБС — 86%. Пациентов со значимой регургитацией в группах с относительной МН в течение 8 лет выявлено не было.
Рис. 5. Свобода от рецидива МР в течение 8 лет.
Видео:Пролапс митрального клапана. Опасный порок сердца?Скачать

Обсуждение
ФК МК является составной частью фиброзного скелета сердца. В его структуре преобладают протеогликаны, коллагеновые и эластические волокна, присутствуют гладкомышечные клетки и нервные окончания [6]. Эластичная структура тканей ФК является анатомической предпосылкой возможности гофрирования тканей с низкой вероятностью прорезывания швов. При этом не наблюдается надрывов вследствие связывания нитей и натяжения тканей. Это было также подтверждено гистологическим исследованием данной области. Линия швов проходила интрамурально на глубине около 2—2,5 мм от Ф.К. При этом не наблюдалось микротравм ни тканей ФК, ни стенки ЛП [5, 7].
«Золотым стандартом» коррекции МН различной этиологии в настоящее время является АП ОК меньшего диаметра, чем измеренное межтригональное расстояние [1—3, 6, 8, 10]. На ранних сроках после операции (менее 12 мес) 15—30% пациентов имели МН II и более степени [1, 3, 5, 8]. В литературе представлено множество исследований по определению предикторами неудовлетворительных результатов использование асимметричных О.К. Наиболее важными среди них являются дилатация камер сердца, конечный диастолический размер (КДР) ЛЖ более 70 мм, конечный систолический объем (КСО) более 145 мл, глубина коаптации створок более 0,5 см, увеличение угла задней створки более 45°, нарушение сегментарной сократимости в области боковой стенки ЛЖ, диаметр ФК МК более 37 мм, центральная или сложная струя МР и др. [3, 8, 15, 17]. Согласно полученным нами данным, причинами рецидива МР при использовании метода шовной АП являются факторы, связанные с дилатацией и снижением сократительной способности ЛЖ и прогрессированием основного заболевания, но не исходный диаметр Ф.К. Диаметр Ф.К. достоверно не изменялся в отдаленном периоде.
В нашем центре шовная пластика ФК МК выполняется с 2005 г., и к настоящему времени мы располагаем опытом более 1000 операций. При оценке результатов показано, что шовная АП МК позволяет статистически достоверно уменьшить размеры ФК, что способствует улучшению коаптации створок за счет увеличения длины и уменьшения глубины коаптации. Было установлено, что корректно выполненная АП редуцирует отверстие МК на 34,8±5,7%. При этом уменьшение площади ФК МК не сопровождалось статистически значимым формированием градиента. По данным разных авторов [14, 16, 18], у 11% пациентов регистрируется функциональный митральный стеноз после имплантации ОК и сопровождается клинической картиной сердечной астмы. Отсутствие инородного ригидного материала, нормальная структура створок и подклапанного аппарата дают определенную свободу движений и возможность адаптироваться форме МК после выполнения АП, что, на наш взгляд, и является объяснением отсутствия градиента давления. Помимо этого, безимплантационная АП практически полностью нивелирует возможность развития ИЭК МК, описанного при имплантации ОК, и стенозирование выходного отдела ЛЖ [14].
Одним из наиболее важных преимуществ методики является простота ее выполнения, что позволяет значительно снизить время аноксии миокарда. Среднее время (15 мин) формирования шовной АП у большинства хирургов укладывает в один сеанс кровяной изотермической кардиоплегии.
Таким образом, полученные нами результаты показали, что представленная в работе методика пластики ФК является эффективной при коррекции митральной недостаточности различной этиологии, технически несложной и не требующей специального материального оснащения. Наш опыт применения шовной АП МК позволяет говорить об удовлетворительных непосредственных и отдаленных результатах коррекции М.Н. Ее использование позволило устранить или уменьшить степень МН, не прибегая к протезированию клапана, у 86,2% прооперированных больных. При этом эффективная редукция диаметра ФК МК не сопровождалась формированием артифициального митрального стеноза.
МН, сформировавшаяся на фоне расширения ФК, может быть эффективно скорригирована методом безимплантационной (шовной) А.П. Восстановление коаптации створок МК достигается за счет уменьшения диаметра ФК в среднем на 35%, что не сопровождается формированием митрального стеноза (максимальный градиент давления после пластики 4,7±1,1 мм рт.ст., средний — 2,2±0,6 мм рт.ст.). Использование безимплантационной методики исключает возможность стенозирования выходного отдела ЛЖ и значительно снижает риск развития ИЭК М.К. Предикторами рецидива митральной регургитации или ее прогрессирования в отдаленном периоде являются экстрааннулярные факторы.
🎥 Видео
«Митральная регургитация. Виды, методы лечения»Скачать

Пролапс митрального клапана. Симптомы и лечениеСкачать

Симпозиум «На приеме пациент с недостаточностью аортального и/ или митрального клапана.»Скачать

Кальциноз фиброзного кольца митрального клапанаСкачать

Анатомия и визуализация митрального клапанаСкачать

Эхокардиография в диагностике и ведении пороков аортального клапана сердцаСкачать

Отрыв хорды передней створки митрального клапана в сегменте А2Скачать

Пролапс митрального клапана: лечить или нет?Скачать

Пролапс митрального клапана. Что это и как быть.Скачать

Протезирование аортального клапанаСкачать

Пролапс митрального клапана. Когда бить тревогу?Скачать

Недостаточность митрального клапана. СимптомыСкачать

ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА. УГРОЗА ИЛИ НЕТ?Скачать

Недостаточность митрального клапана. Симптомы, диагностика и лечениеСкачать

Злокачественный аритмогенный пролапс митрального клапана – частая недооцененная проблема ЭхоКГСкачать

Пролапс митрального клапана: болезнь сердца, которую жизненно-важно вовремя распознать!Скачать


















