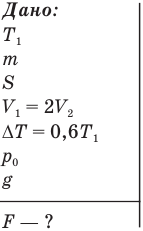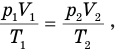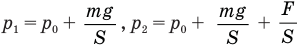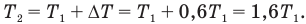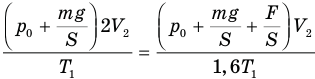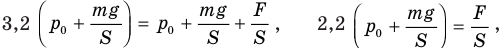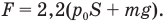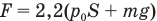- 4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
- Пример
- Решение:
- Как найти массу газа в баллоне?
- Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
- Задача С2. В цилиндре под поршнем находится газ. Масса поршня m, площадь его основания S. С какой силой надо давить на поршень, чтобы объем воздуха под ним уменьшился вдвое и при этом температура воздуха будет повышена на 60% ? Атмосферное давление нормальное. Трением пренебречь.
- 📽️ Видео
Видео:Молярная масса. 8 класс.Скачать

4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Читайте также: Цилиндр для замка морелли
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Видео:Одноатомный идеальный газ в цилиндре переводится из состояния А в состояние B так, что его масса - №Скачать

Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
Видео:МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Как найти массу газа в баллоне?
3 сообщений
Откуда: Уфа
Кто: Специалист
Возраст: 33
Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
3 сообщений
Откуда: Уфа
Кто: Специалист
Возраст: 33
Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:
Читайте также: Рассчитать объем жидкости в цилиндре вертикальном
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
А в каких единицах измерения подставлять значения.
А в каких единицах измерения подставлять значения.
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда \(P = 24.5\; МПа = 2.45 \cdot 10^7 \; Па\) ,
\(T=293\;K\) (нормальная комнатная температура).
3 сообщений
Откуда: Уфа
Кто: Специалист
Возраст: 33
А в каких единицах измерения подставлять значения.
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда \(P = 24.5\; МПа = 2.45 \cdot 10^7 \; Па\) ,
\(T=293\;K\) (нормальная комнатная температура).
Огромное спасибо за помощь
601 сообщений
Откуда: Интернет
Кто: В поисках истины
Возраст: 34
zam, тут давление больно высокое.
У Метан Tk=190,65 К Pk=45,8 атмосферы
Плохо помню какие есть методы исследовани я веществ в критическом состоянии и как они себя видут, но думается там уже будет жидкость, а не пар.
Относительный удельный вес жидкого метана 0,555
но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа. ».
Так что, условия там такие, что метан в газообразном состоянии.
601 сообщений
Откуда: Интернет
Кто: В поисках истины
Возраст: 34
но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа. ».
Так что, условия там такие, что метан в газообразном состоянии.
Так Вы фразу целиком читайте. «Какая масса газа уместиться в такой баллон?»
Это не значит, что газ в болоне, это значит что закачиваем мы газ. А балон такой что сжимает газ до жидкого состояния.
Видео:Урок 28 (осн). Вычисление массы и объема тела по плотностиСкачать

Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
а) сделать запись уравнения соответствующей условию задачи реакции. Расставить правильно стехиометрические коэффициенты;
б) сделать расчёт числа молей в-ва, количество которого указано в задаче. Если речь идёт о массе какого-то в-ва (А), то применить формулу:
Если указаны объёмы газа, то вычислять по формуле:
- VA – объём газа A;
- Vm – молярный объём, равный для всех газообразных в-в при н.у. 22,4 л/моль.
Примечание. Если кол-во вещества даётся в молях, то его находить уже не требуется.
Читайте также: Высота цилиндра площадь боковой поверхности 4 длина окружности основания 1
в) затем определить моли искомого в-ва (В), используя следствия из закона Авогадро –
- nA и nB – кол-во веществ А и В,
- kA и kB – коэффициенты перед ними в уравнении.
г) определив количество в-ва В, найти его массу:
для газообразного в-ва В использовать соответствующую формулу:
сделать расчёт кол-ва сероводорода, т.к. из условия известен его объём:
используя принцип одинаковости отношений кол-ва вещества к его стехиометрическому коэффициенту в данной реакции n(Al2S3)/k(Al2S3) = n(H2S)/k(H2S),
вычислить необходимое для реакции количество молей сульфида аллюминия:
n(Al2S3) = n(H2S)· k(Al2S3)/ k(H2S) = 1,5 моль ·1/3 = 0,5 моль
Видео:Одноатомный идеальный газ в цилиндре переводится из состояния A в состояние B так, что его масса - №Скачать

Задача С2. В цилиндре под поршнем находится газ. Масса поршня m, площадь его основания S. С какой силой надо давить на поршень, чтобы объем воздуха под ним уменьшился вдвое и при этом температура воздуха будет повышена на 60% ? Атмосферное давление нормальное. Трением пренебречь.
Задача С2. В цилиндре под поршнем находится газ. Масса поршня m, площадь его основания S. С какой силой надо давить на поршень, чтобы объем воздуха под ним уменьшился вдвое и при этом температура воздуха будет повышена на 60% ? Атмосферное давление нормальное. Трением пренебречь.
Обозначим 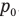
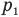
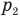
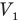
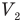
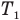
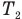
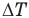
Согласно условию при неизменной массе воздуха под поршнем изменялись все три параметра его состояния: давление, объем и температура. Поэтому применим объединенный газовый закон:
С учетом условия задачи и этих равенств первое уравнение примет вид: ,
Ответ: .
Эта задача взята со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти задачи:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
📽️ Видео
Как найти молекулярную массуСкачать
11 класс. Геометрия. Объем цилиндра. 14.04.2020Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Относительная плотность газов (D). Определение понятия. Как этим пользоваться при решении задач.Скачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Закон Авогадро. Молярный объем. 8 класс.Скачать

Химия 8 класс (Урок№8 - Количество вещества. Молярная масса. Молярный объём газа. Закон Авогадро.)Скачать

Определение молярной массы углекислого газаСкачать

Химия | Относительная атомная и молекулярная массаСкачать

Наконецто нашёл бесконечную проблему. пропуски цилиндрыСкачать

Молярная масса смеси газов. Часть 1. Задачи по химииСкачать

КАРТЕРНЫЕ ГАЗЫ ИЗ ЗАЛИВНОЙ ГОРЛОВИНЫ, ЧТО ЭТО ТАКОЕ КОГДА БИТЬ ТРЕВОГУ ПОЛНЫЙ РАЗБОРСкачать

Зависимость объёма газа данной массы от его температурыСкачать

Утрачены миллионы нервных клеток и тысячи рублей, а причина копеечная.Скачать

Задача 2. Найти число молекул в единице массы углекислого газа; найти массу одной молекулы.Скачать