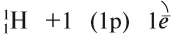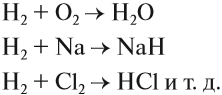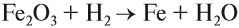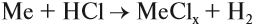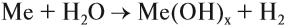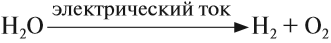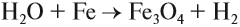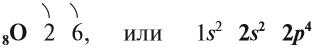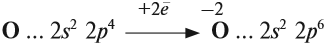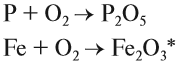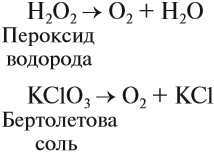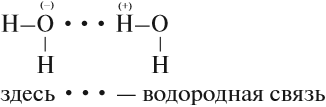Видео:🔥 ЭЛЕКТРОЛИЗ ВОДЫ. ЛУЧШИЕ ЭЛЕКТРОДЫ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА И КИСЛОРОДА.Скачать

Как определить в каком цилиндре кислород а в каком водород
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

§29. СВОЙСТВА И ПРИМЕНЕНИЕ ВОДОРОДА
1. Один цилиндр заполнен водородом, а другой – кислородом. Как определить, в каком цилиндре находится каждый из газов?
Для проверки газа в цилиндрах можно использовать тлеющую лучинку. В цилиндре с кислородом лучинка ярко вспыхнет.
2. Как перелить из одного сосуда в другой а) водород; б) кислород?
Водород легче воздуха и переливать его надо «вверх», а кислород тяжелее воздуха, и переливать его надо «вниз». То есть, так как кислород тяжелее воздуха, то для того, чтобы перелить из одного сосуда в другой кислород, необходимо сосуд с кислородом расположить сверху, а пустой – снизу. Так как водород намного легче воздуха, то для переливания водорода нужно поместить сосуд с водородом снизу, а пустой – сверху.
3. Составьте уравнения химических реакций водорода со следующими оксидами: а) оксидом ртути (II); б) железной окалиной Fe₃O₄; в) оксидом вольфрама (VI). Объясните, какова роль водорода в этих реакциях. Что происходит с металлом в результате реакции?
В данных реакциях водород выполняет роль восстановителя. А металлы восстанавливаются до простых веществ.
4. Используя рисунок 39, создайте свой вариант презентации из 7-8 слайдов по теме «Применение водорода». Обсудите свою презентацию с соседом по парте.
Презентацию можно скачать, воспользовавшись поиском по нашему сайту.
5. Руководствуясь планом, приведенным в задании 3 после §26, подготовьте компьютерную презентацию по теме «Водород».
Презентацию можно скачать, воспользовавшись поиском по нашему сайту.
Тестовые задания
1. В соединении NH₃ водород проявляет валентность
I
2. В уравнении реакции PbO₂+2H₂=Pb+2H₂O восстановителем является
Водород
3. Левая часть уравнения реакции: …+…= Hg+H₂O – это HgO+H₂=
Видео:Взаимодействие кислорода с водородомСкачать

Урок 12. Водород и кислород
Видео:Забудьте всё что слышали про бензин! Это прорыв! Двигатель на нагретом бензопаре!Скачать

Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Читайте также: Коленвал маз 6 цилиндров
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
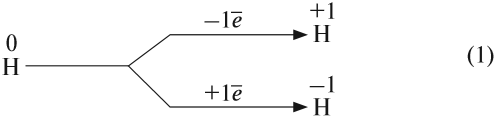
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
Читайте также: Пропуск первого цилиндра тойота хайлендер
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Читайте также: Тема цилиндр для старшей группы
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Видео:Нумерация цилиндров, как определить где какой номер цилиндра?/how to determine cylinder number?Скачать

Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
🔥 Видео
Как получить ЖИДКИЙ ВОЗДУХ и что с ним можно сделать?Скачать

Самый простой способ получения кислорода | Реакция марганцовки на перекись водородаСкачать

Получение кислорода из пероксида водородаСкачать

Габриелян химия 8 кл решение задачи 3 стр 172Скачать

Создать воду из кислорода и водорода - 🔎миф или правда🔍Скачать

Химия | КислородСкачать

ТОСОЛ в ЦИЛИНДРАХ Симптомы Диагностика Ремонт (К4М)Скачать

Получение кислорода из пероксида водорода.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Водород/химические свойства водорода/8 классСкачать

Получение кислорода для дыхания в домашних условиях из перекиси водорода. Мой способ.Скачать

Кислород. 8 класс.Скачать

33. Кислород. Методы полученияСкачать

Раздельное получение водорода и кислорода. Стальная мембрана. Самовольный электролиз | Водород-11Скачать